
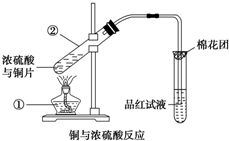
 如图是铜与浓硫酸反应的实验装置图,请回答下列问题.
如图是铜与浓硫酸反应的实验装置图,请回答下列问题.分析 (1)根据图示装置中仪器的构造及名称进行解答;
(2)铜与浓硫酸反应生成硫酸铜、二氧化硫和水;
(3)二氧化硫具有漂白性,通过品红试液能使品红溶液褪色;
(4)SO2和NO2溶于水生成酸;
(5)二氧化硫有毒,能与氢氧化钠溶液的反应;
(6)证明硫酸有剩余,需要验证有H+存在即可.
解答 解:(1)装置中标号①的仪器的名称为:酒精灯,②是试管;
故答案为:酒精灯;试管;
(2)铜与浓硫酸反应生成硫酸铜、二氧化硫和水,其反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)由于二氧化硫具有漂白性,所以将产生气体通入品红试液中的现象为:品红试液褪色,
故答案为:品红试液褪色;
(4)SO2和NO2溶于水生成酸,所以它们会引起雨水呈酸性;
故答案为:酸性;
(5)二氧化硫与氢氧化钠溶液可以反应,二氧化硫有毒,需要进行尾气吸收,所以图中棉花团中浸有氢氧化钠溶液的作用是:吸收多余的SO2,防止污染空气,
故答案为:吸收多余的SO2,防止污染空气;
(6)能用来证明反应结束后的溶液中确有硫酸,可以通过证明反应后的溶液中存在氢离子即可,
a.碳不与稀硫酸反应,无法证明,故a错误;
d.BaCl2溶液加入后出现白色沉淀,但因为生成产物中有硫酸铜生成,也可以生成白色沉淀,不能证明硫酸有剩余,故b错误;
c.银粉不与稀硫酸反应,不能证明硫酸有剩余,故c错误;
d.Na2CO3溶液会与稀硫酸反应发出二氧化碳气体,可以证明硫酸剩余,故d正确,
故答案为:d.
点评 本题考查了浓硫酸性质、二氧化硫的性质及检验方法,题目难度中等,注意掌握浓硫酸的化学性质,明确二氧化硫的漂白性原理,能够正确书写出铜与浓硫酸反应的化学方程式、离子方程式,侧重于考查学生的分析能力和实验探究能力.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 容器里气体的密度为40 g/L | |
| B. | SO3的分解率为30% | |
| C. | 在这10 min内的平均速率为v(O2)=0.05 mol•L-1•min-1 | |
| D. | 化学反应速率:v(Ag2SO4)=v(SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
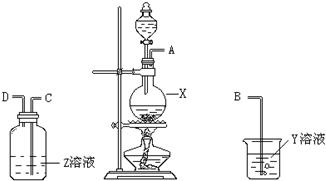 某化学课外兴趣小组为探究铜与浓硫酸反应产物的性质,拟用如图所示的装置进行实验.
某化学课外兴趣小组为探究铜与浓硫酸反应产物的性质,拟用如图所示的装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
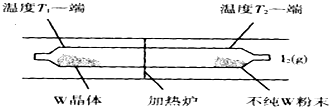
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
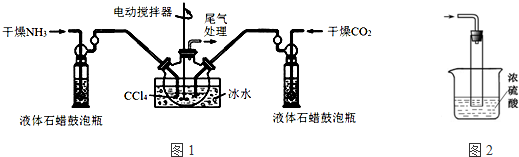
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com