
| A. | 浓硫酸、浓盐酸和浓硝酸长期暴露在空气中,质量都会减小、浓度都会降低 | |
| B. | 氯水和活性炭都可使红墨水褪色,其原理相同 | |
| C. | 浓硝酸见光会分解,故有时在实验室看到的浓硝酸呈黄色 | |
| D. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 |
分析 A、浓硫酸具有吸水性,浓盐酸具有挥发性;
B、氯水是氧化还原褪色,而活性炭是吸附褪色;
C、浓硝酸具有不稳定下,见光分解生成二氧化氮、氧气和水;
D、浓H2SO4有强氧化性,在加热的条件下能与Cu发生剧烈反应.
解答 解:A、浓硫酸具有吸水性,浓盐酸具有挥发性,二者在空气中浓度都变低,但浓硫酸的质量增加,故A错误;
B、氯水是氧化还原褪色,而活性炭是吸附褪色,所以原理不同,故B错误;
C、浓硝酸不稳定,见光分解生成二氧化氮,二氧化氮溶于硝酸而使硝酸显黄色,故C正确;
D、浓H2SO4有强氧化性,在加热的条件下能与Cu发生剧烈反应,在常温下不反应,故D错误;
故选C.
点评 本题考查了元素化合物知识,为高考热门考点,侧重基础知识的考查,明确物质的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 进入煤矿矿井时,用火把照明 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 实验时,蒸发结晶时,当有大量晶体析出时再用玻璃棒搅拌 | |
| D. | 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
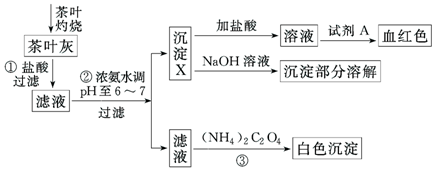
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
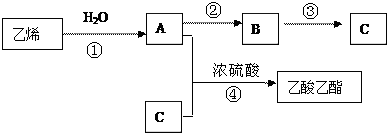
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
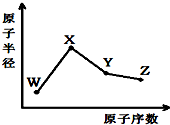 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题:
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 在强碱性溶液中,[Al(OH)4]-、HCO3-、Na+、Ca2+可能同时大量共存 | |
| C. | 铁船底镶嵌锌块,构成原电池,锌作负极,以防船体被腐蚀 | |
| D. | 用量筒量取10.mL 1.0mol/L的盐酸于100mL溶液瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3+4OH-═2FeO42-+3Cl-+5H2O | |
| B. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 铜溶于浓硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②(NH4)2SO4、③CH3COONH4、④NH3•H2O;c(NH4+)由大到小的顺序是:②>①>③>④ | |
| C. | 物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+)+c(H+)=c(S2-)+c (HS-)+c(OH-) | |
| D. | AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,Ksp减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com