
分析 (1)根据反应方程式找出使混合物溶于水无剩余,则n(Al) 与 n(Na2O2)的关系;
(2)氢氧化铝与盐酸反应生成氯化铝和水;
(3)Al与Na2O2在水中发生的反应分别为2Na2O2+2H2O=4NaOH+O2↑和2Al+2NaOH+2H2O=2NaAlO2+3H2↑,加入盐酸后又发生了反应NaOH+HCl═NaCl+H2O、NaAlO2+HCl+H2O=Al(OH)3↓+NaCl、Al(OH)3+3HCl=AlCl3+3H2O,可得反应的关系式:Al~NaAlO2~Al(OH)3~AlCl3~3HCl,Na2O2~2NaOH~2NaCl~2HCl,根据反应的关系式来列式计算;
(4)开始生成沉淀时,原溶液中的氢氧化钠恰好被盐酸中和,根据(3)得出剩余氢氧化钠的物质的量,再计算出消耗盐酸的体积.
解答 解:(1)Al与Na2O2在水中发生的反应分别为:2Na2O2+2H2O=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,要使混合物溶于水无剩余,则n(Al) 与 n(Na2O2)的关系须满足,则铝的物质的量必须≤钠离子的物质的量,即:2n(Al)≤n(Na2O2),
故答案为:2n(Al)≤n(Na2O2);
(2)生成的沉淀为氢氧化铝,氢氧化铝能够溶于盐酸,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
(3)Al与Na2O2在水中发生的反应分别为:2Na2O2+2H2O=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
加入盐酸后又发生了反应:NaOH+HCl═NaCl+H2O、NaAlO2+HCl+H2O=Al(OH)3↓+NaCl、Al(OH)3+3HCl=AlCl3+3H2O,
最后所得溶液中的溶质是NaCl和AlCl3,
综合上述五个化学方程式可得如下关系式:Al~NaAlO2~Al(OH)3~AlCl3~3HCl,Na2O2~2NaOH~2NaCl~2HCl,
设原混合物中xmolAl,有ymolNa2O2,则依关系式
Al~3HCl Na2O2~2HCl
x 3x y 2y
结合题给数据可建立等式:27x+78y=1.05 ①、3x+2y=1×50×10-3 ②,
联立①②两式解得:x=y=0.01mol,
则Al的质量为:0.01mol×27×g/mol=0.27g,Na2O2的质量为:0.01mol×78g/mol=0.78g,
答:原混合物中A 的质量为0.27g,Na2O2的质量为0.78g;
(4)开始出现沉淀时,原溶液中剩余的氢氧化钠恰好被盐酸中和,根据(3)可知,0.01mol过氧化钠完全反应生成0.02molNaOH,而0.01mol铝消耗0.01molNaOH,故反应后剩余0.01molNaOH,中和0.01molNaOH需要消耗0.01molHCl,则消耗1mo1/L的盐酸的体积为:V(HCl)=$\frac{0.01mol}{1mol/L}$=0.01L=10mL,
答:滴加盐酸过程中开始出现沉淀时盐酸的体积为10mL.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,试题知识点较多,充分考查了学生的分析能力及化学计算能力,注意掌握关系式法在化学计算中的应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用三聚氰胺配制的奶粉 | B. | 加有大量亚硝酸钠(NaNO2)的火腿 | ||
| C. | 用碳酸钡做x射线透视的“钡餐” | D. | 加碘盐(含碘酸钾的食盐) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| C. | 1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 | |
| D. | CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
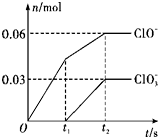 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示.下列说法不正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化关系如图所示.下列说法不正确的是( )| A. | Cl2和苛性钾溶液在不同温度下可能发生不同反应 | |
| B. | 反应中转移电子数为是0.42 NA | |
| C. | 原苛性钾溶液中KOH的物质的量为0.3 mol | |
| D. | 生成物中Cl-的物质的量为0.21 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的氧化物是离子化合物 | |
| B. | X的氢化物溶于水显酸性 | |
| C. | 常温时Z单质的氧化性比X单质的氧化性弱 | |
| D. | X和 Z的最高价氧化物对应的水化物都是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | P3>P2 T3>T2 | B. | P2>P4 T4>T2 | C. | P1>P3 T3>T1 | D. | P1>P4 T2>T3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
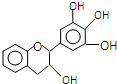 “茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 该有机物的分子式是C15H13O5 | |
| B. | 1mol EGC与4molNa生成气体体积为44.8L | |
| C. | 易发生氧化反应和取代反应,难发生加成反应 | |
| D. | 分子中所有的原子共面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com