

分析 (1)原子的电子层数越少,其原子半径越小,同一周期元素中,原子半径随着原子序数增大而减小;
(2)金属性越强与水反应越剧烈,金属性最强的元素是Na元素;
(3)气态氢化物的水溶液呈碱性的气体是NH3;
(4)非金属性越强,气态氢化物越稳定.
解答 解:(1)原子的电子层数越少,其原子半径越小,同一周期元素中,原子半径随着原子序数增大而减小,最大的是Na元素,
钠原子结构示意图为 ,故答案为:Na;
,故答案为:Na; ;
;
(2)金属性最强的元素是Na元素,金属性越强,性质越活泼,与水反应越剧烈,故答案为:Na;
(3)气态氢化物的水溶液呈碱性的气体是NH3,所以元素是氮元素,故答案为:N;
(4)非金属性越强,气态氢化物越稳定,F元素的非金属性最强,故氟化氢最稳定,故答案为:HF.
点评 本题考查了元素周期表及元素周期律综合应用,涉及化学式、原子结构等化学用语,再结合元素周期律分析解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ② | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL 1 mol•L-1的稀硝酸溶液 | B. | 40mL 0.5 mol•L-1的稀硫酸溶液 | ||
| C. | 40mL 1 mol•L-1的FeCl3溶液 | D. | 60mL 0.5 mol•L-1的稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质在水溶液中的电离过程是不可逆的 | |
| B. | 强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 | |
| C. | 易溶于水的电解质一定是强电解质 | |
| D. | 难溶于水的电解质一定是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 15 | C. | 20 | D. | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
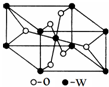 海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
海底热液研究处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com