
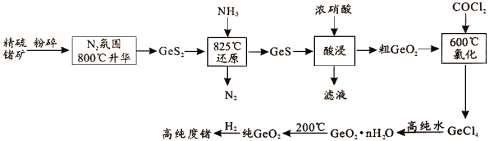
【题目】今年为门捷列夫发现元素周期律150周年。门捷列夫预言了很多未知元素,锗是其中一种,工业上用精硫锗矿(主要成分为GeS2)制取高纯度锗,其工艺流程如图所示。请回答:
(1)锗在元素周期表中的位置是__________。
(2)800℃,在N2氛围中使精硫锗矿升华的目的是______________。
(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式____。酸浸时温度不能过高的原因是_____
(4)GeCl4易水解生成GeO2·nH2O,此过程化学方程式为_____。温度对GeCl4水解率的影响如图所示,为提高水解率,实验时可采取的措施为______(填序号)。

A.冰水浴
B.冰盐水浴
C.49℃水浴
(5)请判断25℃时0.1mol·L-1NaHGeO3溶液pH________(填“>”=”或“<”)7,理由是____(已知25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13)。
【答案】第四周期第ⅣA族 避免GeS2被氧化,得到较为纯净的GeS2 GeS+8H++10NO3 =GeO2+ SO42+10NO2↑+4H2O 浓硝酸受热易分解 GeCl4+(n+2)H2O = GeO2·nH2O↓+4HCl B > NaHGeO3溶液中水解程度大于电离程度,溶液显碱性,故pH>7
【解析】
根据流程:粉碎精硫矿(主要成分为GeS2),在800℃,在N2氛围中使精硫矿升华,得到较为纯净的GeS2,加入氨气在825℃条件下将其还原为GeS,用浓硝酸酸浸:GeS+8H++10NO3-=GeO2+SO42-+10NO2↑+4H2O,得到粗GeO2,用COCl2将其氧化为GeCl4,加入高纯水水解得到GeO2nH2O,200℃将其脱水得到纯GeO2,最后用氢气将其还原得到高纯度Ge,据此分析作答。
(1)Ge在元素周期表中的位置是第四周期第ⅣA族;
(2)根据题干信息可知在N2氛围中使精硫锗矿升华的目的是避免GeS2被氧化,得到较为纯净的GeS2;
(3)浓硝酸酸浸GeS时Ge、S元素均被氧化到最高价态,则生成GeO2、SO42-,NO3-被还原为二氧化氮气体,离子反应为:GeS+8H++10NO3-=GeO2+SO42-+10NO2↑+4H2O;浓硝酸受热易分解,故酸浸时温度不能过高;
(4)GeCl4易水解生成GeO2nH2O,反应为:GeCl4+(n+2)H2O=GeO2nH2O↓+4HCl,根据图表,温度低时水解率较高,提高水解率,即促使反应正向进行,可加盐,故选用冰盐水浴,答案为B;
(5)已知:H2GeO2的Ka1=1.7×10-9,Ka2=1.9×10-13,NaHGeO3水解平衡常数Kh=![]() =
=![]() =
=![]() ×10-5>Ka2=1.9×10-13,即NaHGeO3溶液中水解程度大于电离程度,溶液显碱性,故pH>7。
×10-5>Ka2=1.9×10-13,即NaHGeO3溶液中水解程度大于电离程度,溶液显碱性,故pH>7。


科目:高中化学 来源: 题型:
【题目】Na2CO3是重要的化工原料,工业上采用NH3、CO2、NaCl为原料来制备。某兴趣小组用NH4HCO3固体替换NH3和CO2,按照下列流程在实验室模拟制备Na2CO3。

完成下列填空:
(1)步骤1中,为控制反应温度在30~35℃,应选用的加热方式是_______________;实验前NH4HCO3固体须在____________里(填仪器名称)磨成粉末,且加入时要不断搅拌,这些操作的目的是_____________________________________________________________。
(2)步骤3中,使用饱和NaHCO3溶液洗涤白色固体的原因是____________________________。
(3)步骤4中,恒温炉内发生的化学反应为______________________________(书写化学方程式)。
为检验产品纯度,该小组按如下流程操作:

(4)判断操作II中滴加Ba(OH)2溶液是否过量的方法是___________________________________。
(5)若样品中杂质不与Ba(OH)2反应,则Na2CO3的质量分数为____________(小数点后保留两位)。
(6)若样品中所含杂质是NaHCO3、NaCl中的一种或两种,①如何确定样品中是否含有NaCl,设计实验方案_________________________________________________________________。
②有同学认为,根据上述实验数据就可以判断出样品中一定含有NaCl,无需再实验检验,判断的理由是____________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的分子式为C8H18
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的一氯代物只有4种
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,AgX(X=Cl、Br)的溶度积与c(Ag+)和c(X-)的相互关系如下图所示,其中A线表示AgCl,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。下列说法正确的是( )

A. c点可表示AgCl的不饱和溶液
B. b点的AgCl溶液加入AgNO3晶体可以变成a点
C. t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K=10-4
AgBr(s)+Cl-(aq)平衡常数K=10-4
D. t℃时,取a点的AgCl溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了如图所示的一系列的星烷,如三星烷、四星烷、五星烷等。下列说法正确的是


A. 它们之间互为同系物
B. 六星烷的化学式为C18H22
C. 三星烷与丙苯互为同分异构体,四星烷与 互为同分异构体
互为同分异构体
D. 它们的一氯代物均只有两种而三星烷得二氯代物有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,几种酸的电离平衡常数如下:

回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的①NaClO溶液 ②Na2CO3溶液 ③NaHCO3溶液 ④Na2SO3溶液,pH值由大到小的顺序是____________________。(填序号)
(2)用离子方程式表示NaClO溶液呈碱性的原因是____________________________________________。
(3)0.1mol/L的氯化铵溶液中各离子物质的量浓度由大到小的顺序是___________,只改变下列一个条件,能使c(NH4+)与c(Cl-)比值变大的是______________________。(填标号)
A.加入固体硫酸铵
B.通入少量氯化氢
C.降低溶液温度
D.加入少量固体氢氧化钠
(4)假设25 ℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-6mol/L,则在该温度下此溶液中氨水的电离平衡常数:Kb(NH3·H2O)=_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体,它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题:

(1)甲物质为____________(填化学式)。
(2)乙与甲反应的化学方程式为____________,丙与甲反应的化学方程式为____________。
(3)D能使湿润的有色布条褪色,其褪色原因是____________(结合化学反应方程式描述原因)。
(4)D可用于制取“84”消毒液,反应的化学方程式为____________,也可用于工业上制取漂白粉,反应的化学方程式为____________,但漂白粉保存不当易变质,变质时涉及到的化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)达到平衡时,测得PCl3为0.2 mol,如果此时再向容器中充入1.0 mol PCl3 和1.0 mol Cl2,在相同温度下再次达平衡时,PCl3 的物质的量是
PCl3(g)+Cl2(g)达到平衡时,测得PCl3为0.2 mol,如果此时再向容器中充入1.0 mol PCl3 和1.0 mol Cl2,在相同温度下再次达平衡时,PCl3 的物质的量是
A. 0.2 mol B. 大于0.4mol
C. 0.4 mol D. 大于0.2 mol,小于0.4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

(1)该反应为_______反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量_______(填“高”或“低’’)。
(3)反应物化学键断裂吸收的能量____(填“高’’或“低’’)于生成物化学键形成放出的能量。
(4)写出一个符合题中条件的化学方程式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com