
 ��
��
| Ka1 | Ka2 | |
| H2SO3 | 1.3��10-2 | 6.3��10-8 |
| H2CO3 | 4.2��10-7 | 5.6��10-11 |
���� ��1����S��16��Ԫ�أ�Sԭ�ӻ��2�����ӱ�ΪS2-�������ӵĽṹʾ��ͼΪ�� ��
��
�ڼ���ʱ����Ԫ�ص�����������Ӧˮ�����Ũ��Һ��Ũ������ľ̿��Ӧ���ɶ�����̼�����������ˮ��
��2����pH=13ʱ��c��S2-��=5.7��10-2mol/L����0.10mol•L-1H2S��Һ�и������غ�c��H2S��+c��HS-��+c��S2-��=0.10mol•L-1��
�ڵ�Qc=Ksp��MnS��ʱ��ʼ�������ɴ���������ӵ�Ũ�ȣ����ͼ��ó���ʱ��pH��
��3����HSO3-�ĵ��뷽��ʽΪ��HSO3-?H++SO32-��ƽ�ⳣ������ʽΪK=$\frac{c��{H}^{+}��•c��S{O}_{3}^{2-}��}{c��HS{O}_{3}^{2-}��}$��
��Na2SO3��Һ�Լ��ԣ�SO32-��������ˮ�⣬�Ե�һ��ˮ��Ϊ����ˮ��̶Ƚ�С���ݴ��ж�����Ũ�ȹ�ϵ��
���ɱ���֪H2SO3�Ķ�������С��H2CO3��һ�����룬������ǿ��H2SO3��H2CO3��HSO3-�����Է�Ӧ����Ҫ���ӷ���ʽΪH2SO3+HCO3-=HSO3-+CO2��+H2O��������ΪH2SO3+2HCO3-=SO32-+2CO2��+2H2O��
��� �⣺��1����S��16��Ԫ�أ�Sԭ�ӻ��2�����ӱ�ΪS2-�������ӵĽṹʾ��ͼΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
�ڼ���ʱ����Ԫ�ص�����������Ӧˮ�����Ũ��Һ��Ũ������ľ̿��Ӧ���ɶ�����̼�����������ˮ����Ӧ�ķ���ʽΪ��C+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$2SO2��+CO2��+2H2O���ʴ�Ϊ��C+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$2SO2��+CO2��+2H2O��
��2����pH=13ʱ��c��S2-��=5.7��10-2mol/L����0.10mol•L-1H2S��Һ�и������غ�c��H2S��+c��HS-��+c��S2-��=0.10mol•L-1������c��H2S��+c��HS-��=0.1-5.7��10-2=0.043mol/L���ʴ�Ϊ��0.043��
�ڵ�Qc=Ksp��MnS��ʱ��ʼ����������c��S2-��=$\frac{Ksp��MnS��}{c��M{n}^{2+}��}$=$\frac{2.8��1{0}^{-13}}{0.020}$=1.4��10-11mol/L�����ͼ��ó���ʱ��pH=5������pH=5ʱ�����ӿ�ʼ�������ʴ�Ϊ��5��
��3����HSO3-�ĵ��뷽��ʽΪ��HSO3-?H++SO32-��ƽ�ⳣ������ʽΪK=$\frac{c��{H}^{+}��c��S{{O}_{3}}^{2-}��}{c��HS{{O}_{3}}^{-}��}$���ʴ�Ϊ��$\frac{c��{H}^{+}��c��S{{O}_{3}}^{2-}��}{c��HS{{O}_{3}}^{-}��}$��
��Na2SO3��Һ�Լ��ԣ�SO32-��������ˮ�⣺SO32-+H2O?HSO3-+OH-��HSO3-+H2O?H2SO3+OH-���Ե�һ��ˮ��Ϊ����ˮ��̶Ƚ�С����0.1mol/L Na2SO3��Һ�е�����Ũ��˳��Ϊ��c��Na+����c��SO32-����c��OH-����c��HSO3-����c��H+�����ʴ�Ϊ��c��Na+����c��SO32-����c��OH-����c��HSO3-����c��H+����
���ɱ���֪H2SO3�Ķ�������С��H2CO3��һ�����룬��������ǿ��H2SO3��H2CO3��HSO3-�����Է�Ӧ����Ҫ���ӷ���ʽΪH2SO3+HCO3-=HSO3-+CO2��+H2O��������ΪH2SO3+2HCO3-=SO32-+2CO2��+2H2O���ʴ�Ϊ��H2SO3+HCO3-=HSO3-+CO2��+H2O��
���� ���⿼��Ԫ��ԭ�ӽṹʾ��ͼ����д���������ʵĻ�ѧ����ʽ��д���ε�ˮ��ƽ�⡢������ʵ���ƽ�⡢�����ܽ�ƽ���֪ʶ������Ũ�ȴ�С�Ƚϵ�Ӧ�ã�


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Һ����NaOH��Һ����Cl2�Ʊ���Cl2+2OH-�TClO-+Cl?+H2O | |
| B�� | ������Һ��pHԼΪ12��ClO-+H2O?HClO+OH-? | |
| C�� | ������Һ�����飨��Ҫ�ɷ�ΪHCl�����ã������ж�Cl2��2H++Cl-+ClO-�TCl2��+H2O | |
| D�� | ������Һ�Ӱ״�����HClO������ǿƯ�����ã�CH3COOH+ClO-�THClO+CH3COO-? |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
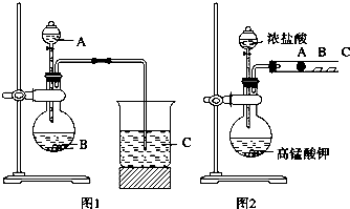
| A�� | X��Y��Z����ʹ��ˮ��ɫ | |
| B�� | X��Z������NaHCO3��Һ��Ӧ�ų�CO2 | |
| C�� | Y���ܷ���ȡ����Ӧ��Ҳ�ܷ����ӳɷ�Ӧ | |
| D�� | Y�����Ӿ۷�Ӧ���壬X�������۷�Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ϩ�����к�̼̼˫�� | B�� | �Ե���Ϊԭ�Ͽ���ȡ�������� | ||
| C�� | ������3��ͬ���칹�� | D�� | ��֬��������Ӧ���ڼӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
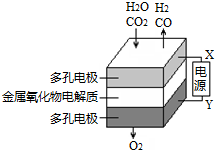 �ڹ�̬��������������У����¹����H2O-CO2��������Ʊ�H2��CO��һ���µ���Դ���÷�ʽ������ԭ����ͼ��ʾ������˵������ȷ���ǣ�������
�ڹ�̬��������������У����¹����H2O-CO2��������Ʊ�H2��CO��һ���µ���Դ���÷�ʽ������ԭ����ͼ��ʾ������˵������ȷ���ǣ�������| A�� | X�ǵ�Դ�ĸ��� | |
| B�� | �����ķ�Ӧʽ�ǣ�H2O+2e-�TH2+O2-��CO2+2e-�TCO+O2- | |
| C�� | �ܷ�Ӧ�ɱ�ʾΪ��H2O+CO2$\frac{\underline{\;ͨ��\;}}{\;}$H2+CO+O2 | |
| D�� | �������������ɵ���������ʵ���֮����1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| Y | Z | ||
| X | W |
| A�� | ԭ�Ӱ뾶��X��Y��Z | |
| B�� | ��̬�⻯����ȶ��ԣ�X��Z | |
| C�� | Z��W������Mg�γ����ӻ����� | |
| D�� | ����������Ӧˮ��������ԣ�Y��W |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 �ִ�����ѧ����-����������о�����Ϊ��Ծ������֮һ��������ͼ�Ǽ����ϳɵ�����������-��������ķ��ӽṹ���йظ�����˵��������ǣ�������
�ִ�����ѧ����-����������о�����Ϊ��Ծ������֮һ��������ͼ�Ǽ����ϳɵ�����������-��������ķ��ӽṹ���йظ�����˵��������ǣ�������| A�� | ����ʽΪS4N4 | B�� | �����м��м��Լ����зǼ��Լ� | ||
| C�� | �۵����ͬ�ྦྷ��S2N2 | D�� | �۷е�ͣ�Ӳ�Ƚ�С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 b��
b�� c��
c��
 b��
b�� c��CH3OCH3
c��CH3OCH3 b��
b�� c��
c��
 �������õķ������ʹ�Ч���㷺Ӧ����ʳƷ��ҵ��
�������õķ������ʹ�Ч���㷺Ӧ����ʳƷ��ҵ��
 ��
�� ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com