
Cu+2FeCl3![]() CuCl2+2FeCl2
CuCl2+2FeCl2
设计一个原电池并写出电极反应,并画出简易图。
科目:高中化学 来源:导学大课堂必修二化学鲁科版 鲁科版 题型:058
从理论上说氧化还原反应可以设计为原电池.根据反应:
Cu+2FeCl3![]() CuCl2+2FeCl2
CuCl2+2FeCl2
设计一个原电池并写出电极反应,并画出简易图.
查看答案和解析>>
科目:高中化学 来源:活题巧解巧练·高考化学(第一轮) 题型:058
从理论上说氧化还原反应可以设计为原电池.试根据反应:Cu+2FeCl3=CuCl2+2FeCl2,设计一个原电池并写出电极反应.
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省高三9月份月考化学试卷 题型:选择题
某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L 的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是( )
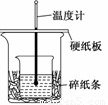
A.如图条件下实验过程中没有热量损失
B.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求反应热相等
C.图中实验装置缺少环形玻璃搅拌棒
D.烧杯间填满碎纸条的作用是固定小烧杯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com