
| A、①<②<③<④ |
| B、①<③<④<② |
| C、②<④<③<① |
| D、④<③<②<① |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 电离平衡常数(25℃) |
| NH3?H2O | Kb=1.77×10-5 |
| HCN | Ka=4.93×10-10 |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
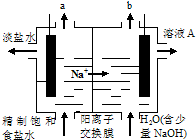
| A、溶液A的溶质是NaOH |
| B、阴极附近溶液pH升高 |
| C、气体a为氯气,其电极反应为2Cl--2e-═Cl2↑ |
| D、与产生气体b的电极相连的是电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-Y |
| B、-(10X-Y) |
| C、-(5X-O.5Y) |
| D、+(10X-Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入滴加BaCl2溶液,立即产生白色沉淀 | 原溶液中一定有SO42- |
| B | 在K2CrO7溶液中加入NaOH溶液,溶液由橙色变为黄色 | K2CrO7与NaOH溶液发生了氧化还原反应 |
| C | 在滴有酚酞的Na2CO3溶液中,滴加入BaCl2溶液,溶液红色逐渐褪去 | Na2CO3溶液中存在水解平衡 |
| D | 用铂丝蘸取溶液进行颜色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6NA |
| B、常温常压下,46g NO2与N2O4的混合气体中含有的分子总数为NA |
| C、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
| D、一定量的钠与8g氧气作用,若两者均无剩余,转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
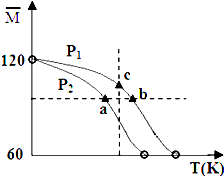 已知 (CH3COOH)2(g)═2CH3COOH(g),经实验测得不同压强、不同温度下,体系达到平衡状态时平均摩尔质量(
已知 (CH3COOH)2(g)═2CH3COOH(g),经实验测得不同压强、不同温度下,体系达到平衡状态时平均摩尔质量(. |
| M |
| m总 |
| n总 |
| A、该过程的△H<0 |
| B、气体压强:P(a)<P(b)=P(c) |
| C、平衡常数:K(a)=K(b)<K(c) |
| D、测定乙酸的相对分子质量要在高压、低温条件下进行,以提高乙酸纯度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,14g N2含有的分子数为0.5NA |
| B、25℃、101.3kPa时,11.2LH2中含有的原子数为NA |
| C、标准状况下,1mol CCl4的体积约为22.4L |
| D、2.3g的金属钠变为钠离子时失去的电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com