
| A. | KNO3溶液 | B. | FeCl3溶液 | C. | Al2(SO4)3溶液 | D. | FeSO4溶液 |
分析 溶液加热蒸干后,能析出原溶质固体的,需要溶质性质稳定,不分解、不能被氧化、不能水解或水解程度不大,据此分析.
解答 解:A、KNO3是强酸强碱盐,不能水解也不能分解,也不能被氧化,故加热蒸发能得到KNO3本身,故A正确;
B、FeCl3是强酸弱碱盐,在溶液中水解:FeCl3+3H2O?Fe(OH)3+3HCl,由于HCl是挥发性酸,故加热时挥发,导致水解被促进,则蒸干后得到的是Fe(OH)3,故B错误;
C、Al2(SO4)3是强酸弱碱盐,在溶液中会水解:Al2(SO4)3+6H2O?2Al(OH)3+3H2SO4,由于硫酸不挥发,故加热时水解被促进的程度很小,蒸干后Al(OH)3和H2SO4又能反应生成Al2(SO4)3,故得到的是溶质本身,故C正确;
D、FeSO4有强还原性,在蒸干时会被氧化为Fe2(SO4)3,得到的不是溶质本身,故D错误.
故选AC.
点评 本题考查盐类水解知识,题目难度不大,注意把握物质的稳定性和水解的性质,易错点为C,注意硫酸盐水解的特点.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:解答题
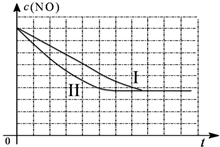
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) (mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| Ⅲ | 350 | 1.20×10-3 | 5.80×10-3 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、OH-、H3O+ | B. | Na+、Mg2+、S2- | C. | F-、NH2-、Cl- | D. | Li+、Na+、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热的纯碱溶液去污能力强 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 用Na2S溶液与AlCl3溶液混合制取Al2S3 | |
| D. | 碳酸钡和硫酸钡都可以用做钡餐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、NO3-、Cl- | B. | K+、Na+、Cl-、CO32- | ||
| C. | NH4+、Na+、Cl-、SO42- | D. | NH4+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 该反应NH3被还原 | D. | 生成1 mol N2有6 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池放电过程中,正极电极反应式为:NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 充电过程中阴极的电极反应式:H2O+M+e-═MH+OH-,H2O中的H被M还原 | |
| C. | 充电过程中OH-离子从阳极向阴极迁移 | |
| D. | NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
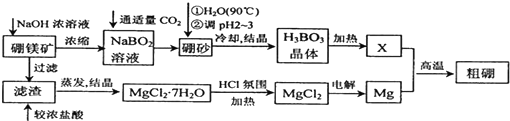
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I- | B. | HCO${\;}_{3}^{-}$ | C. | Cl- | D. | NO${\;}_{3}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com