
【题目】镀作为一种新兴材料日益被重视,有“超级金属…尖端金属…空间金属”之称。工业上常用绿柱石(主要成分3BeO.Al2O3·6SiO2,还含有铁等杂质)冶炼铍,一种简化的工艺流程如下:
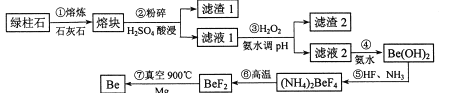
按元素周期表的对角线规则,Be和Al性质相似;几种金属阳离子的氢氧化物沉淀时的pH如表。回答下列问题:

(1)步骤②中将熔块粉碎的目的是_____________;滤渣1的主要成分是________。
(2)步骤③加入H2O2时发生反应的离子方程式为__________,从滤液1中得到沉淀的合理pH为__________(填序号)。
A 3.3-3.7 8 3.7—5.0 C 5.0~5.2 D.5.2—6.5
(3)步骤④不宜使用NaOH溶液来沉淀Be2+的原因是_____________。从溶液中得到(NH4)2BeF4的实验操作是_______、过滤、洗涤、干燥。
(4)步骤⑥的反应类型是_______,步骤⑦需要隔绝空气的环境,其原因是_____________。
(5)若绿柱石中Be0的含量为a%,上述过程生产Be的产率为b%,则1t该绿柱石理论上能生产含铍量2%的镀铜合金_______t。
【答案】 增大与硫酸的接触面积,提高反应速率 H2SiO3 2Fe2++H2O2+2H+==2Fe3++2H2O C 过量的NaOH溶液会溶解Be(OH)2(或不易确保Be2+沉淀完全) 蒸发浓缩、冷却结晶 分解反应 高温下空气中的氮气、氧气都可与镁或铍反应,从而降低产率 1.8×10-3ab(或![]() )
)
【解析】(1)将熔块粉碎能增大与硫酸的接触面积,提高酸浸时的反应速率;SiO2与石灰石高温下反应生成硅酸钙,硅酸钙在用硫酸进行酸浸时生成H2SiO3沉淀。答案为:增大与硫酸的接触面积,提高反应速率 、H2SiO3
(2)步骤③中加入H2O2的目的是把Fe2+氧化为Fe3+,便于铁杂质的除去,发生反应的离子方程式为:2Fe2++H2O2+2H+==2Fe3++2H2O;从滤液1中得到的沉淀为Fe(OH)3、Al(OH)3,调节PH既要Fe3+和Al3+沉淀完全又不能使Be2+沉淀,根据几种金属阳离子的氢氧化物沉淀时的pH表可知,合理pH为5.0~5.2。
答案为:2Fe2++H2O2+2H+==2Fe3++2H2O 、 C
(3)Be和Al性质相似,用NaOH溶液来沉淀Be2+会导致Be(OH)2被溶解,不宜使用NaOH溶液来沉淀Be2+;对溶液进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可以得到(NH4)2BeF4 固体。答案为:过量的NaOH溶液会溶解Be(OH)2(或不易确保Be2+沉淀完全)、蒸发浓缩、冷却结晶
(4)步骤⑥中(NH4)2BeF4通过分解反应生成BeF2;步骤⑦中,空气中含有氮气和氧气,氮气和氧气都能与镁或铍发生反应,降低Be的产率。答案为:分解反应 、 高温下空气中的氮气、氧气都可与镁或铍反应,从而降低产率
(5)根据题知条件可得铍铜合金的质量=![]() =1.8×10-3ab(或
=1.8×10-3ab(或![]() )吨,答案为:1.8×10-3ab(或
)吨,答案为:1.8×10-3ab(或![]() )
)


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】(1)已知:①Fe(s)+![]() O2(g)=FeO(s) H1=-272.0kJ/mol
O2(g)=FeO(s) H1=-272.0kJ/mol
②2Al(s)+![]() O2(g)=Al2O3(s) H1=-1675.7kJ/mol
O2(g)=Al2O3(s) H1=-1675.7kJ/mol
Al和FeO发生铝热反应的热化学方程式是__________________。某同学认为,铝热反应可用于工业炼铁,你的判断是_____(填“能”或“不能”),理由是________。
(2)反应物与生成物均为气态的某可逆反应在不可条件下的反应历程分别为A、B如图所示。
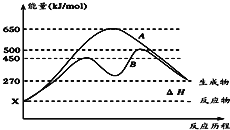
①据图判断该反应是_______(填“吸”或“放”)热反应。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(3)铝热法是常用的金属冷炼方法之一。已知:
4A1(s)+3O2(g)=2Al2O3(s) H=-3352kJ/mol
Mn(s)+O2(g)=MnO2(s)H=-521kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是___________________。
(4)中国气象局的数据显示,2013年企国平均雾霾天数为52年来之最。形成雾霾的主要成分为生产生活中排放的废气,汽车尾气及扬尘等。用CH4可以消除汽车尾气中氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)H=-955kJ/mol
2NO2(g)=N2O4(g) H=-56.9kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为;
(2)反应是反应.(选填“吸热”、放热).
(3)能判断该反应是否达到化学平衡状态的依据是 . a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(CH2)=c(CO)c(H2O),试判断此时的温度为℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种元素的原子序数依次减小且三者原子序数之和为16,其常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是
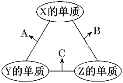
A. X元素位于ⅥA族
B. 1 mol Y和3 mol Z在一定条件下充分反应生成2 mol C
C. A和C在一定条件下能发生氧化还原反应
D. C和X一定条件下能反应生成A和B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质(A、B、C、D)的物质的量变化如图M所示,对该反应的推断合理的是( ) 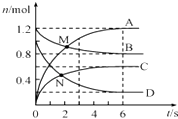
A.M点表示v(A)=v(B)
B.0~6s内,v(A):v(B):v(C):v(D)=3:1:1.5:2
C.反应进行到6s时,各物质的物质的量浓度相等
D.反应进行到6s时,C的平均反应速率为 0.1molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol碳在氧气中完全燃烧生成气体,放出393kJ的热量,下列热化学方程式表示正确的是
A.C (s) +1/2O2 (g) = CO(g) ΔH=-393kJ·molˉ1
B.C + O2 = CO2 ΔH=-393kJ·molˉ1
C.C (s) + O2 (g)=CO2 (g) ΔH=+393kJ·molˉ1
D.C(s)+O2(g)=CO2(g) ΔH=-393kJ·molˉ1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法不正确的是
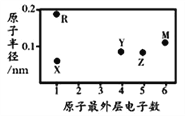
A. 简单阳离子半径:X
B. M的氢化物常温常压下为气体,分子间无氢键
C. 最高价氧化物的水化物的酸性:Z<Y
D. X与Y可以形成平面形结构的分子,分子中存在极性共价键和非极性共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com