
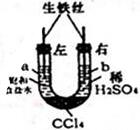
 利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )
利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间.下列说法不正确的是( )| A. | a管发生吸氧腐蚀,b管发生析氢腐蚀 | |
| B. | 一段时间后,a管液面高于b管液面 | |
| C. | a处、b处溶液的pH都增大 | |
| D. | a、b两处具有相同的电极反应式:Fe-3e-═Fe3+ |
分析 A、生铁在酸性条件下发生析氢腐蚀,在碱性或中性条件下发生吸氧腐蚀;
B、根据U型管两边气体压强的变化判断液面的变化;
C、根据发生析氢腐蚀和吸氧腐蚀时溶液中溶质判断溶液pH值的变化,氢氧根离子浓度增大是pH值增大,氢离子浓度减小的pH值增大;
D、负极上金属失电子发生氧化反应.
解答 解:A、U型管左边装置是中性溶液,所以发生吸氧腐蚀,右边装置是酸性溶液发生析氢腐蚀,故A正确;
B、左边装置发生吸氧腐蚀时,氧气和水反应导致气体压强减小,右边装置发生析氢腐蚀,生成氢气导致气体压强增大,所以右边的液体向左边移动,所以一段时间后,a管液面高于b管液面,故B正确;
C、a处铁失电子生成亚铁离子,氧气得电子和水反应生成氢氧根离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,所以a处pH不变;b处溶液变成硫酸亚铁溶液,溶液的pH值变大,故C正确;
D、a、b两处构成的原电池中,铁都作负极,所以负极上具有相同的电极反应式:Fe-2e-=Fe2+,故D错误;
故选D.
点评 本题以铁的吸氧腐蚀和析氢腐蚀为载体考查了原电池原理,明确钢铁发生吸氧腐蚀和析氢腐蚀的条件是解本题的关键,根据析氢腐蚀和吸氧腐蚀时两极发生的反应来分析解答即可,难度不大.


科目:高中化学 来源: 题型:解答题

| 水/硝酸钙 | 0.8:1 | 0.9:1 | 0.95:1 | 1:1 | 1.05:1 | 1.1:1 | 1.15:1 |
| 浸出率/% | 83.1 | 94.5 | 98.2 | 99.1 | 99.5 | 99.6 | 99.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R与Z形成的是共价化合物 | |
| B. | 原子半径:W>R>Z | |
| C. | W的气态氢化物的热稳定性比Y的弱 | |
| D. | R的最高价氧化物的水化物酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电能与化学能之间的转化具有重要的使用价值.
电能与化学能之间的转化具有重要的使用价值.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
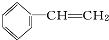 分子中,处于同一平面上的原子数最多可能16个.
分子中,处于同一平面上的原子数最多可能16个.
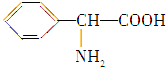 、
、 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
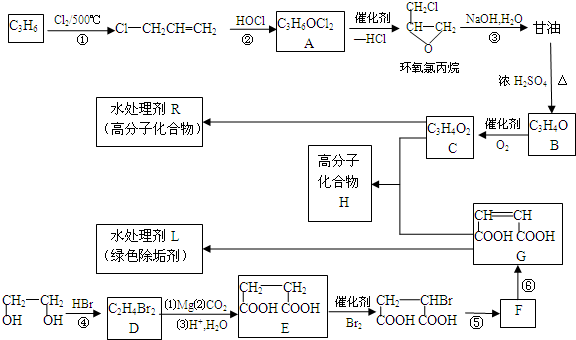
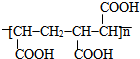 .
.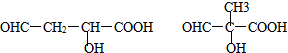
 的合成路线(无机原料任选).
的合成路线(无机原料任选).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com