
| A、KMnO4 |
| B、Na2CO3 |
| C、Cu2O |
| D、Fe2(SO4)3 |


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
| A、64g O3含有的分子数目为2NA |
| B、标准状况下,22.4L H2O含有的氢原子数目为2NA |
| C、1L 1mol?L-1 CaCl2溶液中含有的氯离子数目为2NA |
| D、56g铁在足量氯气中完全燃烧转移的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH3-CH3+Br2
| |||
B、2CH3CHO+O2
| |||
| C、CH3-CH═CH2+Br2→CH3-CHBr-CH2Br | |||
D、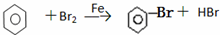 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为摇摆电池的工作原理图,在充放电过程中Li+在两极间“摇来摇去”,其总反应为:LiCoO2+6C
如图为摇摆电池的工作原理图,在充放电过程中Li+在两极间“摇来摇去”,其总反应为:LiCoO2+6C | 充电 |
| 放电 |
| A、放电时,负极反应为:LiCoO2-═Li(1-x)CoO2+xLi+ |
| B、充电时,B极发生还原反应 |
| C、充电时,Li+穿过隔离膜向B极移动 |
| D、当A极得到x mol电子,电池消耗6 mol C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类、蛋白质是高分子化合物,适当的条件下可以发生水解反应 |
| B、甲烷和氯气光照条件下发生取代反应,产物是气体与液体混合物 |
| C、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
| D、乙醇与乙酸不能混合,因为二者可以马上生成乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 | ||
| A | 其单质是密度最小的物质 | ||
| B | 其阴离子带两个单位的负电荷,单质是空气主要成分之一 | ||
| C | 其阳离子与B的阴离子具有相同的电子层结构,其原子的最外层电子数是次外层的
| ||
| D | 其氢氧化物和氧化物都有两性,且与C同周期 | ||
| E | 与C同周期,其原子半径在该周期最小 | ||
| R | 有多种化合价,其最高正价为+6价 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、CaC2、 碱石灰、Cu、Zn、Na2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com