
分析 反应的方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,反应中Al元素化合价由0价升高为+3价,Fe元素化合价由+3价降低到0价,以此解答该题.
解答 解:反应的方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,反应中Al元素化合价由0价升高为+3价,Fe元素化合价由+3价降低到0价,则氧化剂为Fe2O3,还原产物为Fe,若有0.3mol的电子发生转移,则生成0.1molFe,质量为0.1mol×56g/mol=5.6g.
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;Fe;Fe2O3;5.6.
点评 本题考查氧化还原反应以及铝热反应,为高频考点,侧重考查学生的分析能力、计算能力,注意把握物质的性质以及元素化合价的变化,难度不大.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| B. | 铁丝与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| C. | 氯化亚铁溶液和氯气反应:Fe2++Cl2═Fe3++2Cl- | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 亚硫酸钠固体与硫酸反应制二氧化硫 | |
| B. | 铜与稀硝酸反应制一氧化氮 | |
| C. | 氯化铵与氢氧化钙固体反应制氨气 | |
| D. | 锌和稀硫酸反应制氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短周期元素是指1~20号元素 | |
| B. | 核素的种类和元素的种类一样多 | |
| C. | 元素周期表中共有18列、16个族 | |
| D. | 主族元素的最高正价均等于其族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分馏石油的方法可获取汽油 | |
| B. | 用分液的方法分离乙醇和水的混合物 | |
| C. | 用蒸发、结晶、灼烧的方法从硫酸铜溶液中获取胆矾(CuSO4?5H2O) | |
| D. | 用溶解、过滤的方法除去KNO3中的KC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅晶体是良好的半导体,可用于制造光导纤维 | |
| B. | 高压钠灯发出的黄光透雾能力强,可用于道路和广场照明 | |
| C. | 生石灰能与水反应,可用于除去HC1气体中少量的水蒸气 | |
| D. | 氢氧化钠具有强碱性,可用于制胃酸中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,30 g乙烷气体中所含有的共价键数目为6NA | |
| B. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA | |
| C. | 常温下,1 L pH=12的氨水溶液中含有NH4+数目为0.01NA | |
| D. | 1mol乙酸和1mol乙醇充分反应生成的水分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
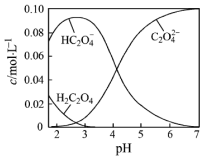 H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )
H2C2O4为二元弱酸.20℃时,配制一组c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol•L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示.下列指定溶液中微粒的物质的量浓度关系一定不正确的是( )| A. | pH=7的溶液中:c(Na+)>2c(C2O42-) | |
| B. | c(Na+)=0.100 mol•L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-) | |
| C. | c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol•L-1+c(HC2O4-) | |
| D. | c(HC2O4-)=c(C2O42-)的点的坐标为(4.3,0.5),则Na2C2O4的水解平衡常数为Kh=1×10-9.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com