
右图是已经合成的一种硫氮化合物的分子结构,下列说法中正确的是
 A.该物质属原子晶体
A.该物质属原子晶体
B.该物质具有很高的熔、沸点
C.该物质的分子中既有极性键又有非极性键
D.该物质与化合物S2N2互为同素异形体
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
 CH3OH(g)△H1=-116kJ?molˉ1
CH3OH(g)△H1=-116kJ?molˉ1| 1 |
| 2 |
| 1 |
| 2 |

| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
 化的曲线图,请指明图中的压强P1=
化的曲线图,请指明图中的压强P1= CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为| 4a2 |
| V2 |
| 4a2 |
| V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
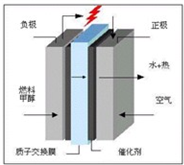
(10分)快乐是什么?精神病学专家通过实验发现:在大脑的相应部位――“奖赏中心”,给予柔和的电击, 便会处于似乎极度快乐的状态。人们已经将“奖赏中心”各部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统。多巴胺结构如右图:
(1)多巴胺分子式: ▲ ;
(2)试判断多巴胺能发生的化学反应 ▲ ;
A.加成 B.取代 C.氧化 D.水解
(3)写出一种符合下列条件的与多巴胺互为同分异构体的物质的结构简式: ▲ 。
①属于1、3、5三取代苯并且苯环上直接连有一个羟基和一个氨基
②分别能与钠和氢氧化钠反应,且消耗钠与氢氧化钠的物质的量之比为2︰1
(4)多巴胺可由香兰素与硝基甲烷缩合,再经锌汞齐还原水解而得。合成过程表示如下:
![]()
写出反应②的化学方程式: ▲
查看答案和解析>>
科目:高中化学 来源:2010-2011学年宁夏高三上学期第五次月考(理综)化学部分 题型:填空题
甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g)  CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ
CH4的转化率与温度、压强的关系如右图。
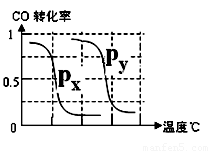
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③该反应的△H 0(填“<”、“>”或“=”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)  CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。
④若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑤为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
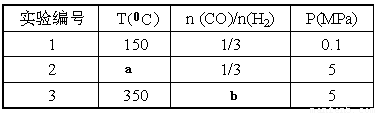
A.则上表中剩余的实验条件数据:a=________ b=_______
B.根据反应Ⅱ的特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Px=_________MPa。
查看答案和解析>>
科目:高中化学 来源:2011年浙江省金华市兰溪市厚仁中学高考化学冲刺试卷(解析版) 题型:填空题
 CH3OH(g)△H1=-116kJ?molˉ1
CH3OH(g)△H1=-116kJ?molˉ1 O2(g)=CO2(g)△H2=-283kJ?molˉ1
O2(g)=CO2(g)△H2=-283kJ?molˉ1 O2(g)=H2O (g)△H3=-242kJ?molˉ1
O2(g)=H2O (g)△H3=-242kJ?molˉ1| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
 CO(g)+2H2(g)反应的平衡常数为
CO(g)+2H2(g)反应的平衡常数为 

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com