
(本题共14分)工业上用氨气与空气混合,通过“氨的催化氧化”等反应工业合成硝酸及其他产品。
1.将NH3与O2在一定条件下充分反应后全部转化为硝酸溶液,则此硝酸溶液中溶质的质量分数为_________________,若所得硝酸密度为ρg/cm3,则其物质的量浓度为 (保留两位小数)。
2.某化肥厂以氨为原料制备 NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为 m3(保留两位小数)。
3.一定量的浓硝酸与铜反应生成NO、NO2、N2O4混合气体。测出混合气体密度是同温同压下氢气的28倍。再将气体通过足量水充分吸收后,体积变为原来的2/3(相同条件下测定)。计算混合气体中NO2的体积分数。
4.合成氨原料气由CH4在高温下与水蒸气、空气反应而得。反应原理如下:
CH4+2H2O→CO2+4H2 2CH4+O2+2H2O→2CO2+6H2
将反应后的混合气中CO2、H2O (g)通过吸收和干燥除去后,只含N2和H2。为使进入合成氨反应塔两者体积比为1∶3。计算起始气体中CH4和空气的比例。(已知空气中O2和N2的体积比为1∶4)。
科目:高中化学 来源:2014-2015学年云南省毕业生复习统一检测理综化学试卷(解析版) 题型:简答题
(14分)BaS是一种白色晶体,微溶于水,可用于制备立德粉、Na2S等。工业上可用H2与重晶石(BaSO4)在高温下反应制备BaS,热化学方程式为BaSO4(s)+4H2(g) BaS(s)+4H2O(g)
BaS(s)+4H2O(g)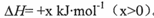 。回答下列问题:
。回答下列问题:
(1)在温度和容积不变的条件下,能说明该反应己达到平衡状态的是 (填字母序号)。
a.n(H2)=n(H2O)
b.容器内压强保持不变
c.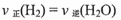
d.水蒸气的浓度保持不变
(2)平衡后下列措施既可提高反应速率,又可提高H2的转化率的是 (填字母序号)。
a.使用催化剂
b.升高反应体系的温度
c.增大反应容器的体积
d.及时从反应体系中分离出水蒸气
(3)将温度恒定为T℃,向体积为2L的密闭容器中加入一定量的重晶石和H2。在不同时间测得H2的物质的量如下表:

①2t时,n 1.20(填“>”、“<”或“=”)
②若氢气的平衡转化率为a,则该温度下反应的化学平衡常数K= (用含a的
代数式表示);若测得该反应达到平衡时吸热Q kJ ,则x= (用含a、Q的代数式表示)。
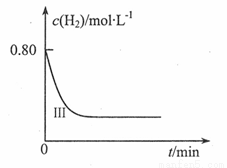
(4)为了探究温度、固体反应物的表面积对化学反应速率的影响,某同学在一固定容积的密闭容器中加入一定量的重晶石和H2,设计了下表中的三组实验:
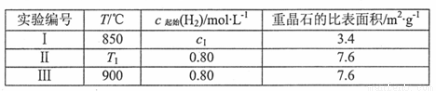
①填写上表中的实验条件: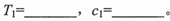
②在直角坐标系中画出I, II两组实验氢气的浓度随时间变化趋势图,并在每条曲线上标明对应的实验编号。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期第二次月考化学试卷(解析版) 题型:选择题
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:
2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正反应为吸热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
SO2有毒,但葡萄酒里都含有SO2,起保鲜、杀菌和抗氧化作用。下列说法不正确的是
A.葡萄酒中的SO2对人体无害,是因为它的含量很少
B.葡萄酒中的SO2具有抗氧化作用,是因为它具有较强的还原性
C.从红葡萄酒的颜色判断,其中的SO2没有漂白性
D.葡萄酒倒入酒杯摇一摇,可以减少其中SO2的含量
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市第二次诊断性测试化学试卷(解析版) 题型:选择题
有关下列四个常用电化学装置的叙述中,不正确的是
|
|
|
|
图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅硫酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
A.图Ⅰ所示装置中,MnO2是正极,工作时其还原产物是MnOOH;
B.图Ⅱ所示装置充电过程中,阴极的电极反应式为:PbSO4(s) + 2e- = Pb(s) + SO42-(aq)
C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图Ⅳ所示装置中,工作时OH-移向锌电极
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:填空题
(本题共12分)含硫化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。回答下列问题:
1.SO2具有还原性,写出将SO2气体通入 FeCl3溶液中的离子方程式,并标出电子转移的数目及方向。______________________________________________________________________
2.在Na2SO3溶液中滴加酚酞,溶液变红色,若在该溶液中滴入过量的BaCl2溶液,现象是_________,请结合离子方程式,运用平衡原理进行解释_____________________。
3.等体积等物质的量浓度的 NaClO溶液与Na2SO3溶液混合后,溶液显______性。此时溶液中浓度相等的微粒是___________________________________________。
4.已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7 Ki2=5.6×10-11
含H2S尾气用足量的Na2CO3溶液来吸收。写出离子反应方程式。____________
常温时,等体积等浓度的Na2S和Na2CO3溶液的离子总数:N前___N后(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:选择题
在高温高压的水溶液中,AuS-与Fe2+发生反应沉积出磁铁矿(主要成分Fe3O4)和金矿(含Au),并伴有H2S气体生成。对于该反应的说法一定正确的是
A.氧化剂和还原剂的物质的量之比2:3
B.AuS-既作氧化剂又作还原剂
C.每生成2.24 L气体,转移电子数为0.1mol
D.反应后溶液的pH值降低
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省鹰潭市高三第二次模拟考试理综化学试卷(解析版) 题型:推断题
【化学——选修5:有机化学基础】(15分)
已知: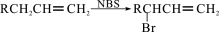 。
。
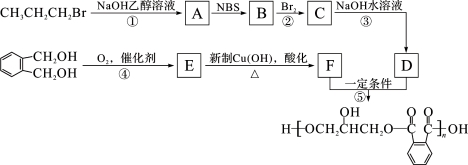
醇酸树脂是一种成膜性良好的树脂,下面是一种醇酸树脂的合成线路:
(1)B中含碳官能团的结构式为_____,C的名称是_____。
(2)反应①的有机反应类型是_____。
(3)下列说法正确的是_____(填字母编号)。
a.1 mol E与足量的银氨溶液反应能生成2 mol Ag
b.F能与NaHCO3反应产生CO2
c.检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是过量氢氧化钠溶液、硝酸银溶液
(4)写出E与新制的氢氧化铜悬浊液反应的化学方程式_____;
(5)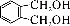 的同分异构体中同时符合下列条件的芳香族化合物共有_____种。
的同分异构体中同时符合下列条件的芳香族化合物共有_____种。
a.能发生消去反应 b.能与过量浓溴水反应
(6)写出反应⑤的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:填空题
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果 (填“偏大”、“偏小”、或“不变”)。
(2)从石油中分离出汽油、煤油和柴油等,所采用的方法是__________(填“干馏”或“分馏”)。
(3)除去二氧化碳气体中的氯化氢杂质,选用的试剂是_______ __(填“NaOH溶液”或“饱和NaHCO3溶液”)。
(4)下图是实验室制取氨气的装置,回答下列问题:
①收集氨气的方法是 排空气法。
②验证氨气是否收集满的方法是 (写一种)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com