
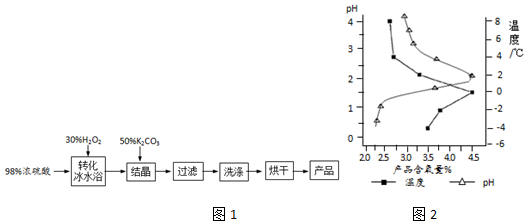
分析 (1)过氧化氢受热易分解;浓硫酸与H2O2反应,部分转化为过硫酸H2SO5和水;
(2)H2SO5与K2CO3即可获得过硫酸氢钾复盐晶体,因为H2SO5为一元强酸,故还有二氧化碳生成;操作中,为避免反应过于剧烈,K2CO3溶液需分批缓慢加入;根据图示,过硫酸氢钾复盐产率(以产品含量氧表示)最大时为该反应的适宜条件;
(3)无水乙醇洗涤沉淀,可以洗除晶体表面的杂质,同时乙醇易挥发,便于晶体干燥;
(4)根据过硫酸氢钾复盐(K2SO4•KHSO4•2KHSO5)易分解分析可得.
解答 解:(1)浓硫酸与H2O2溶液混合时,大量放热,温度高,H2O2易分解,故在“转化”中,用冰水浴冷却;浓硫酸与H2O2反应,部分转化为过硫酸H2SO5和水,反应为:H2SO4+H2O2?H2SO5+H2O;
故答案为:浓硫酸与H2O2溶液混合时,大量放热,温度高,H2O2易分解;H2SO4+H2O2?H2SO5+H2O;
(2)H2SO5与K2CO3即可获得过硫酸氢钾复盐晶体,因为H2SO5为一元强酸,故还有二氧化碳生成,则离子方程式为:10K++5CO32-+4SO42-+4HSO5-+12H+=5CO2↑+2K2SO4•KHSO4•2KHSO5↓+5H2O;为避免反应过于剧烈,K2CO3溶液需分批缓慢加入;根据图示,0℃、pH=2左右时,过硫酸氢钾复盐产率(以产品含量氧表示)最大,故此条件为最适宜条件;
故答案为:10K++5CO32-+4SO42-+4HSO5-+12H+=5CO2↑+2K2SO4•KHSO4•2KHSO5↓+5H2O;控制加入的K2CO3的量,避免反应过于激烈;0℃、pH=2左右;
(3)无水乙醇洗涤沉淀,可以洗除晶体表面的杂质,同时乙醇易挥发,便于晶体干燥;
故答案为:便于晶体干燥;
(4)过硫酸氢钾复盐(K2SO4•KHSO4•2KHSO5)易分解,则烘干产品时,用红外灯低于40℃烘干,可能的原因是产品在40℃以上易分解;
故答案为:产品在40℃以上易分解.
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、实验方案设计、信息获取与迁移运用等,需要学生具备扎实的基础,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 混合气体的总分子数不再变化 | B. | 混合气体的颜色不再变化 | ||
| C. | 容器的总压强不再变化 | D. | 混合气体的总质量不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的皂化反应可得到高级脂肪酸与甘油 | |
| B. | 油脂在酸性或碱性条件下均能发生水解反应,且产物相同 | |
| C. | 可以淀粉为原料制取乙酸乙酯 | |
| D. | 油脂的皂化反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 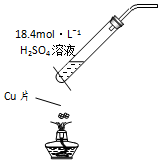 用图装置制取SO2 | |
| B. | 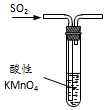 图装置中溶液的颜色变浅,说明SO2具有漂白性 | |
| C. | 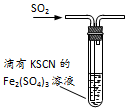 图装置中溶液的颜色变浅,说明SO2具有还原性 | |
| D. |  图装置中产生淡黄色沉淀,说明SO2或H2SO3具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
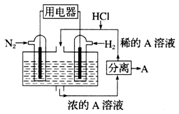 科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )
科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )| A. | A为NH4Cl | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 该电池外电路电子从通入N2的电极流向通入H2的电极 | |
| D. | 通入N2的电极发生的电极反应式为N2+6e-+8H+=2NH+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 军舰船底镶嵌锌块作正极,以防船体被腐蚀 | |
| B. | 汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢 | |
| C. | 金属冶炼过程是金属离子得电子变成金属单质的氧化过程 | |
| D. | PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用葡萄糖制镜或保温瓶胆 | |
| B. | 用漂白液杀菌、消毒 | |
| C. | 用Na2SiO3溶液制备木材防火剂 | |
| D. | 用浸泡过高锰酸钾的硅藻土保鲜水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{Ba(NO_{3})_{2}}{→}$BaSO4 | |
| B. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| C. | MgCl2•6H2O$\stackrel{△}{→}$MgCl2$\stackrel{电解}{→}$Mg | |
| D. | N2$→_{放电}^{O_{2}}$NO2$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com