
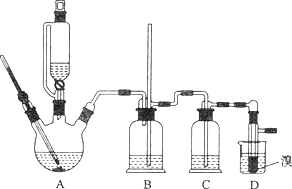
【题目】实验室用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:
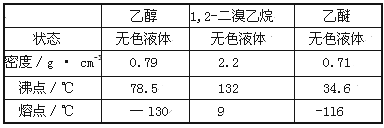
有关数据列表如下:
回答下列问题:
(1)写出该实验过程中发生的所有主要反应的化学方程式:________、_________。
(2)在此制各实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是________(填正确选项前的字母,下同)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入_______,其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)判断该制备反应已经结束的最简单方法是______________(填实验现象)。
(5)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_____层。
(6)若产物中有少量副产物乙醚,可用_______________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是____________;但又不能过度冷却(如用冰水),其原因是__________________________。
【答案】 CH3CH2OH![]() CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2CH2Br d c 溴的颜色完全褪去 下 蒸馏 避免溴大量挥发 产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管
CH2=CH2↑+H2O CH2=CH2+Br2→BrCH2CH2Br d c 溴的颜色完全褪去 下 蒸馏 避免溴大量挥发 产品1,2-二溴乙烷的熔点(凝固点)低,过度冷却会凝固而堵塞导管
【解析】分析:(1)乙醇在浓硫酸170℃的作用下生成乙烯,乙烯和溴水发生加成反应;
(2)乙醇在浓硫酸140℃的作用下发生分子间脱水;
(3)浓硫酸具有强氧化性,可能氧化乙醇中的碳;
(4)乙烯和溴水发生了加成反应;
(5)根据1,2-二溴乙烷和水的密度相对大小解答;
(6)利用1,2-二溴乙烷与乙醚的沸点不同进行解答;
(7)溴易挥发,该反应放热。
详解:(1)乙醇在浓硫酸170℃的条件下,发生消去反应生成乙烯,方程式为CH3CH2OH![]() CH2=CH2↑+H2O。乙烯和溴水发生加成反应生成1,2-二溴乙烷,方程式为CH2=CH2+Br2→BrCH2CH2Br;
CH2=CH2↑+H2O。乙烯和溴水发生加成反应生成1,2-二溴乙烷,方程式为CH2=CH2+Br2→BrCH2CH2Br;
(2)乙醇在浓硫酸140℃的条件下,发生分子内脱水,生成乙醚,所以要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是减少副产物乙醚生成,答案选d;
(3)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,答案选c;
(4)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,所以判断该制备反应已经结束的最简单方法是溴的颜色完全褪去;
(5)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,振荡后静置,产物应在下层;
(6)1,2-二溴乙烷与乙醚的沸点不同,两者均为有机物,互溶,用蒸馏的方法将它们分离;
(7)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,但1,2-二溴乙烷的凝固点9℃较低,不能过度冷却。


科目:高中化学 来源: 题型:
【题目】硫有多种化合物,如H2S、COS(羰基硫)、SO2等,它们对环境均有一定的影响。
(1)H2S经 K2CO3溶液吸收后,生成两种酸式盐。其中无氧酸的酸式盐的化学式是________________。
(2)COS(羰基硫)燃烧时有SO2生成,其原理为:2COS+3O2![]() 2CO2+2SO2。若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是_________________mol。
2CO2+2SO2。若转移3.612×1025个电子,则参加反应COS(羰基硫)的物质的量是_________________mol。
(3)电厂排出的烟气中含有CO、SO2等。它们在一定条件下可转化为一种固体和一种无害气体。该反应的化学方程式是______________________________。其中氧化剂与还原剂物质的量之比为______________。
(4)石灰石作为脱硫剂,可有效吸收废气中的SO2,减少酸雨的产生。
①在煤炭中加入石灰石可减少燃烧时SO2的排放量,并生成CaSO4。该反应的化学方程式是____________。
②你认为减少酸雨产生的途径可采取的措施是____________________(填序号)。
a.避免直接用高硫煤作燃料 b.把工厂的烟囱造高
c.燃料脱硫 d.开发新能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 乙烯使溴水或酸性高锰酸钾褪色均属于加成反应
B. 利用溴水能鉴别苯、乙醇和乙酸三种溶液
C. 用重铬酸钾溶液检验司机是否酒驾所发生的反应属于乙醇的氧化反应
D. 石油的分馏、煤的干馏都是物理变化,而裂化、裂解是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 金刚石和石墨互为同位素B. CH3CH2CH2CH3和CH3CH(CH3)2互为同系物
C. C2H4和C2H6互为同系物D. C2H6和C5H12互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图两套基础实验装置回答问题。
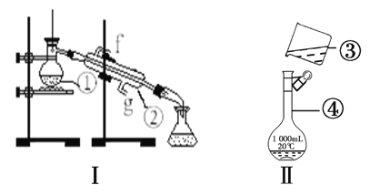
(1)写出下列仪器的名称:______________、___________________。
(2)仪器①~④中,使用时必须检查是否漏水的有____________________。(填序号)
(3)用装置I制蒸馏水,还缺少的仪器有_________,冷却水从_______口进。
(4)a.现需配制250mL0.2molL-1NaCl溶液,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是_______________,_______________。
b.配制过程中,下列情况会使配制结果偏高的是________________(填序号)。
①定容时俯视刻度线观察液面;②容量瓶使用时未干燥;③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线;④移液时未洗涤烧杯和玻璃棒
c.若实验中加蒸馏水时不慎超过了刻度,应如何处理?______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用自来水养鱼,在将水注入鱼缸之前需把水在阳光下爆嗮一段时间,目的是( )
A.增加水中含氧量B.利用阳光中紫外线杀菌
C.使自来水中少量次氯酸分解D.通过日照提高水的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在某酸性的无色溶液中大量共存的是( )
A.NH4+、Mg2+、SO42﹣、Cl﹣B.Ca2+、I﹣、Na+、NO3﹣
C.Al3+、Cu2+、SO42﹣、Cl﹣D.K+、Cl﹣、HCO3﹣、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
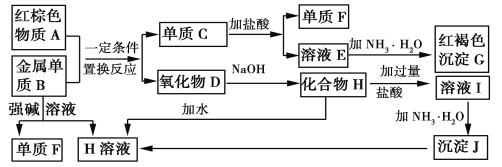
请回答下列问题:
(1)物质A的化学式为__________。
(2)写出单质B与强碱溶液反应的离子方程式____________________________。
(3)溶液E中加入氨水时,先生成白色沉淀L,L最终变为红褐色沉淀G,写出L变为G的化学反应方程式___________。
(4)溶液E敞口放置容易变质,为了防止溶液E的变质,可往溶液中加入___________。
(5)溶液I中所含金属离子是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com