
| A. | ②③ | B. | ②④ | C. | ①③ | D. | ① |
分析 ①根据氧化物的性质分类,是氧化物与酸、碱的反应情况进行分类,将氧化物分成酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物;
②根据反应中是否有电子转移将化学反应分为是氧化还原反应和非氧化还原反应;
③根据分散系的分类依据是分散质微粒直径大小;
④电解质在水溶液中完全电离,而弱电解质电离不完全.
解答 解:①根据氧化物的性质将氧化物分成和碱反应生成盐和水的氧化物为酸性氧化物,和酸反应生成盐和水的氧化物为碱性氧化物,和酸、碱都反应生成盐和水的氧化物为两性氧化物,和酸、碱都不反应的氧化物为不成盐氧化物,故①错误;
②根据反应中是否有盐酸化合价变化,是否有电子转移将化学反应分为是氧化还原反应和非氧化还原反应,故②正确;
③丁达尔现象是胶体的性质,根据分散系分散质微粒大小将分散系分为:分散质微粒直径小于1nm形成的分散系为溶液,分散质微粒直径1nm-100nm形成的分散系为胶体,分散质微粒直径大于100nm形成的分散系为浊液,故③错误;
④电解质在水溶液中完全电离,而弱电解质电离不完全,根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质,故④正确;
故选C.
点评 本题考查物质的分类,题目难度不大,注意物质的分类的依据,不同的分类标准会得出不同的分类结果,注意概念的实质理解.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
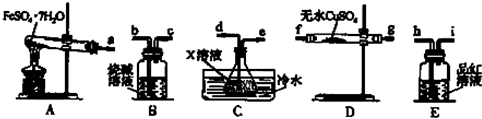
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1012的溶液中:K+、Cl-、NO3-、Fe3+ | |
| B. | 能使甲基橙显红色的溶液:CO32-、Na+、Cl-、SO42- | |
| C. | pH=1的溶液中:Mg2+、SO42-、Fe2+、Cu2+ | |
| D. | 能使铝钝化的溶液中:Ba2+、Na+、Cl-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6 | B. | 2:15 | C. | 2:11 | D. | 1:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L N2和NH3混合气体中原子间共有3NA个共用电子对 | |
| B. | 3.0 g甲醛HCHO和乙酸混合物中共含碳原子数为0.1NA | |
| C. | 25℃时pH=1的醋酸溶液中含有H+的数目为0.1NA | |
| D. | 标准状况下,2.24 L CH2Cl2含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
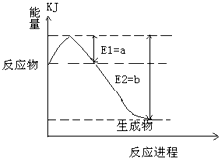 合成氨工业对国民经济和社会发展具有重要意义
合成氨工业对国民经济和社会发展具有重要意义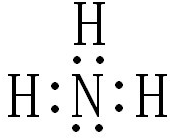
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NH4HCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/LHCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )>c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com