

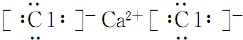 .
.分析 C是温室气体之一为CO2,D和K均可用做干燥剂结合反应条件判断为D为CaO,A为CaCO3,H常温下为液态化合物推断为H2O,M为Ca(OH)2,J是一种具有漂白作用的盐推断为Ca(ClO)2,K为CaCl2,E为Cl2,
结合反应条件和产物,可以推断B为NaCl,电解溶液反应生成产物G为NaOH,F为H2.
解答 解:C是温室气体之一为CO2,D和K均可用做干燥剂结合反应条件判断为D为CaO,A为CaCO3,H常温下为液态化合物推断为H2O,M为Ca(OH)2,J是一种具有漂白作用的盐推断为Ca(ClO)2,K为CaCl2,E为Cl2,
结合反应条件和产物,可以推断B为NaCl,电解溶液反应生成产物G为NaOH,F为H2.
(1)K为CaCl2,电子式为: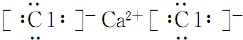 ,
,
故答案为: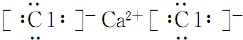 ;
;
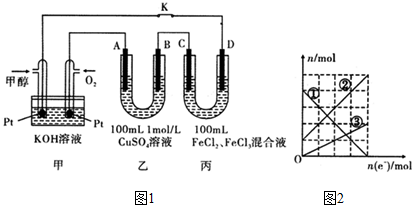
(2)反应Ⅱ阳极发生氧化反应,氯离子放电生成氯气,阳极电极反应式:2Cl--2e-═Cl2↑,若采用如图2所示装置,铁作阳极,失电子被氧化生成Fe2+,正极是氢离子放电生成氢气,c(OH-)增大,与正极的Fe2+生成Fe(OH)2白色沉淀,再被氧化为氢氧化铁,
故答案为:2Cl--2e-═Cl2↑;石墨上有无色气体产生,电解一段时间后在U形管的底部出现白色、灰绿色或红褐色沉淀;
(3)工业上测定反应Ⅲ产品的有效成分J的含量,先将一定量产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果.
①碘单质遇淀粉溶液变蓝,用Na2S2O3标准溶液滴定I2时选用的指示剂为淀粉,随着Na2S2O3标准溶液的滴入,蓝色褪去,
故答案为:淀粉溶液;
②生成I2的反应的离子方程式是:ClO-+2I-+2H+═Cl-+I2+H2O,故答案为:ClO-+2I-+2H+═Cl-+I2+H2O;
(4)在Mg(OH)2饱和溶液中存在:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),Ksp[Mg(OH)2]=c(Mg2+)•c2(OH-),所以c2(OH-)=Ksp[Mg(OH)2]÷c(Mg2+)=(1.0×10-11)÷(1.0×10-4)=1.0×10-7,则c(OH-)=3.16×10-4,所以pH=-1g$\frac{1{0}^{-14}}{3.16×1{0}^{-4}}$≈11,
故答案为:11.
点评 本题考查无机推断,工业生产中常见的反应应用,电子式书写,离子方程式的书写,物质性质的应用、沉淀溶解平衡的计算等,注意掌握中学常见的工业生产原理,根据物质性质的应用、反应特征条件和产物性质进行推断,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不与浓硫酸发生反应 | |
| B. | 过氧化钠可作为防毒面具和潜水艇内的供氧剂 | |
| C. | 可用稀硝酸鉴别铜锌合金制成的假金币 | |
| D. | 氢氟酸可用于雕刻玻璃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 六种物质中:
六种物质中:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A=B | B. | A<B | C. | 无法判断 | D. | A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 白色沉淀A可能能溶解在溶液D | |
| B. | 在甲中滴加丁可能发生反应:HCO3+Ba2++OH-=BaCO3↓+H2O | |
| C. | 溶液丙与I-、N03-、SO42-可以大量共存 | |
| D. | 溶液甲中一定满足:c(H2CO3)+c(H+)═c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
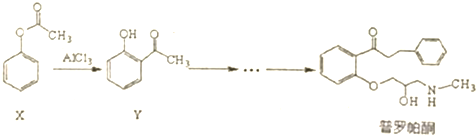
| A. | 普罗帕酮分子中有2个手性碳原子 | |
| B. | 可用溴水或FeCI3溶液鉴别X和Y | |
| C. | 反应物X与中间体Y互为同分异构体 | |
| D. | 普罗帕酮能发生加成、氧化、消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com