
| A. | Q1>Q2 | B. | Q1=Q2 | C. | Q1<Q2 | D. | 无法确定 |
分析 已知CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H=+Q1kJ/mol;CuSO4(s)=Cu2+(aq)+SO42-(aq)△H=-Q2kJ/mol;
胆矾溶于水时,溶液温度降低,反应为CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H′>0;根据盖斯定律确定△H′与Q1、Q2的关系.
解答 解:已知①CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H=+Q1kJ/mol;
②CuSO4(s)=Cu2+(aq)+SO42-(aq)△H=-Q2kJ/mol;
③CuSO4•5H2O(s)=Cu2+(aq)+SO42-(aq)+5H2O(l)△H′>0;
根据盖斯定律:方程③=方程①+方程②,
所以△H′=Q1+(-Q2)>0,即Q1>Q2,
故选A.
点评 本题考查了物质溶解恒容物质分解过程中的能量变化,根据盖斯定律分析物质溶解过程中的能量变化是解题关键,题目难度中等.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. |  |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | 有白色沉淀生成,说明有Ba2+; |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中 | 试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3 |
| 步骤4:取适量滤液于烧杯中,用pH计测其pH值 | pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
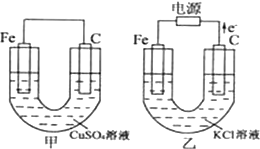 根据如图所提供的信息,在反应一段时间后:
根据如图所提供的信息,在反应一段时间后:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 | ||
| HCl | NaOH | 平均值 | (t2-t1)/℃ | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
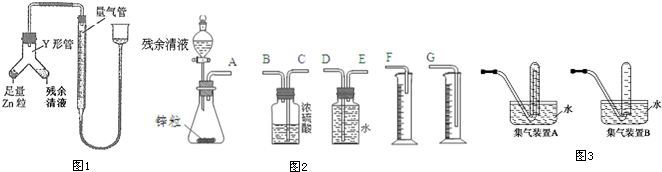
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸的浓度 | B. | 溶液的温度 | C. | Zn颗粒的大小 | D. | 溶液中Cl-的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;中间产品C中混有反应物A和B,检验C中含有A的试剂是NaHCO3溶液.
;中间产品C中混有反应物A和B,检验C中含有A的试剂是NaHCO3溶液. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KHCO3和MgCO3 | B. | MgCO3和NaNO3 | C. | BaCO3和NaHCO3 | D. | Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液,有白色沉淀生成,证明有Cl- | |
| B. | 用硝酸酸化后取上层清液,加入Ba(OH)2溶液,析出白色沉淀,证明有SO42- | |
| C. | 加浓NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝色的气体,证明有NH4+ | |
| D. | 加入盐酸,放出能使澄清石灰水变浑浊的气体,证明含有CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com