
| A�� | 1mol•L-1 Na2CO3��Һ�У���CO${\;}_{3}^{2-}$��ĿС��NA | |
| B�� | 1mol FeCl3��ȫת��Ϊ����������������н���������ĿΪNA | |
| C�� | 25��ʱ��1L pH=12��Ba��OH��2��Һ�к��е�OH-��ĿΪ0.02NA | |
| D�� | 1mol���ͱ�����Ļ������ȫȼ��ʱ����O2�ķ�����Ϊ7.5NA |
���� A����Һ�������ȷ��
B��һ���������������Ƕ�����������ľۼ��壻
C��pH=12������������Һ�У���������Ũ��Ϊ0.01mol/L��
D��1mol����1mol������ȼ��ʱ������7.5mol������
��� �⣺A����Һ�������ȷ������Һ�е�̼����ĸ��������㣬��A����
B��һ���������������Ƕ�����������ľۼ��壬��1mol�Ȼ����γɵ��������������ĸ���С��NA������B����
C��pH=12������������Һ�У���������Ũ��Ϊ0.01mol/L����1L�ĸ���Һ�е��������ĸ���Ϊ0.01NA������C����
D��1mol����1mol������ȼ��ʱ������7.5mol��������1mol���ͱ�����Ļ����ȼ������7.5mol��������7.5NA���������ӣ������ߵı����أ���D��ȷ��
��ѡD��
���� ���⿼���˰���٤���������йؼ��㣬�������ʵ����ļ��㹫ʽ�����ʽṹ�ǽ���ؼ����ѶȲ���


 ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���Ϸ�Ӧ | B�� | �ֽⷴӦ | ||
| C�� | ��Ӧ������л�ѧ������ | D�� | ԭ����ϳɷ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | BeCl2 | B�� | CO2 | C�� | HCl | D�� | N2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ��ȩ | B�� | ��ȩ | C�� | ��ȩ | D�� | ��ȩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ�鷽�� | ʵ��Ŀ�� |
| A | �����ס���������������Һ�й���ԭ��� | ��֤�ס��ҵĻ���ǿ�� |
| B | �ö��Ե缫��ⲻͬŨ�ȵ�AgNO3��Cu��NO3��2�Ļ����Һ | ֤������ͭ�������� |
| C | ��������þ������������Һ�м����Ȼ�����Һ | ֤��Ksp[Fe��OH��3]��Ksp[Mg��OH��2] |
| D | �ⶨ0.1mol•L-1Na2X��0.1mol•L-1Na2Y��Һ��pH | ��֤H2X��H2Y���Ե����ǿ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ����1����2mL 0.005mol•L-1 AgNO3��Һ�м���2mL 0.005mol•L-1KSCN��Һ�����ã� | ���ְ�ɫ������ |
| ����2��ȡ1mL�ϲ���Һ���Թ��У��μ�1��2mol•L-1Fe��NO3��3��Һ�� | ��Һ��Ϊ��ɫ�� |
| ����3������2����Һ�У���������5�� 3mol•L-1AgNO3��Һ�� | ����a���ְ�ɫ��������Һ��ɫ��dz�� |
| ����4������1���µ���Һ�м���5�� 3mol•L-1KI��Һ�� | ���ֻ�ɫ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
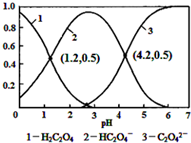
| A�� | pH=1.2��Һ�У�c��K+��+c��H+���Tc��OH-��+c��H2C2O4�� | |
| B�� | pH=2.7��Һ�У�$\frac{{c}^{2}��H{C}_{2}{O}_{4}^{-}��}{c��{H}_{2}{C}_{2}{O}_{4}��}$��c��C2O42-��=1000 | |
| C�� | ����ͬ���ʵ���KHC2O4��K2C2O4������ȫ����ˮ���û��Һ��pHΪ4.2 | |
| D�� | ��pH=1.2����Һ�м�KOH��Һ��pH������4.2�Ĺ�����ˮ�ĵ����һ������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com