
| A. | 葡萄糖和果糖 | B. | 甲烷和乙烷 | C. | 16O和18O | D. | 淀粉和纤维素 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
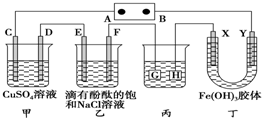
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol•L-1HA溶液的pH=4 | B. | HA溶液跟锌反应,放出H2很慢 | ||
| C. | pH=2的HA溶液稀释100倍后pH=3.5 | D. | 溶液中存在HA的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯 | B. | 乙烯 | C. | 丙烯 | D. | 乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
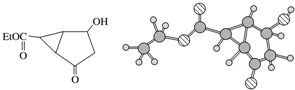
| A. | 该有机物不同化学环境的氢原子有8种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物的分子式为C9H10O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .按pH值由大到小顺序排列正确的是( )
.按pH值由大到小顺序排列正确的是( )| A. | ④①③② | B. | ①④③② | C. | ①②③④ | D. | ④③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈橙红色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈紫红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com