
| A. | 气体的摩尔体积为22.4 L•mol-12 | |
| B. | 1 mol H2的质量是2 g,它所占的体积是22.4 L | |
| C. | 在标准状况下,1 mol任何气体所占的体积都为22.4 L•mol-1 | |
| D. | 在标准状况下,1 mol任何气体所占的体积都约为22.4 L |
分析 A.标准状况下,气体摩尔体积为22.4L/mol;
B.n=$\frac{m}{M}$计算质量,气体标准状况下的气体摩尔体积为22.4L/mol;
C.1mol气体体积在标准状况下为22.4L;
D.标况下,1mol任何气体的体积都为22.4L.
解答 解:A.温度压强不知气体摩尔体积不一定为22.4L/mol,故A错误;
B.1 mol H2的质量=1mol×2g/mol=2 g,温度压强不知它所占的体积不一定是22.4 L,故B错误;
C.在标准状况下,1 mol任何气体所占的体积都为22.4 L,单位错了,故C错误;
D.在标准状况下,1 mol任何气体所占的体积都约为22.4 L,是气体摩尔体积的概念,故D正确;
故选D.
点评 本题考查气体摩尔体积的适用条件和范围,只有在标况下的气体才适用,题目难度不大.


科目:高中化学 来源: 题型:解答题

| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.6 | B. | 0.333 | C. | 0.4 | D. | 0.36 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
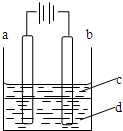 由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀.若用如图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀.已知两极材料分别为石墨和铁:
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱溶液反应制得Fe(OH)2白色沉淀.若用如图所示实验装置,则可制得纯净的Fe(OH)2白色沉淀.已知两极材料分别为石墨和铁:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 小于0.2mol | ||
| C. | 大于0.2mol | D. | 大于0.2mol,小于0.4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取l.06g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中 | |
| B. | 定容时,若仰视,则所配溶液的浓度将偏高 | |
| C. | 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分 | |
| D. | 在使用容避瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O和S4O62-都是还原产物 | |
| B. | 1mol Fe2+参加反应时,转移2mol电子 | |
| C. | Fe2+、S2O32-都是还原剂 | |
| D. | x=2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com