
a g Cu与含b g HNO3的某浓度的硝酸溶液恰好反应,若a : b = 4 : 10.5,则反应中被还原的HNO3质量为( )
A.b g; B.b/2 g ; C.3b/4 g ; D.b/4 g
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
3.2 g Cu与30 mL 3 mol·L-1HNO3溶液充分反应,还原产物有NO2和NO,若反应后溶液中H+为a mol,则此时溶液中所含![]() 为( )
为( )
A.![]() mol B.2a mol C.0.1a mol D.(a+0.1) mol
mol B.2a mol C.0.1a mol D.(a+0.1) mol
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省绍兴一中分校高二12月月考化学试卷(带解析) 题型:单选题
在制作印刷电路板的过程中常利用FeCl3溶液与Cu反应,其反应方程式为:2FeCl3+Cu 2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
| A.残余固体全部是Cu | B.残余固体可能为Fe和Cu的混合物 |
| C.最后得到的溶液可能含有Fe3+ | D.残余固体是Fe,溶液中一定不含Cu2+ |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年浙江省高三上学期期中考试化学试卷(解析版) 题型:实验题
(13分) 某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在”。为此,他们设计了如下图所示的装置。回答下列问题:
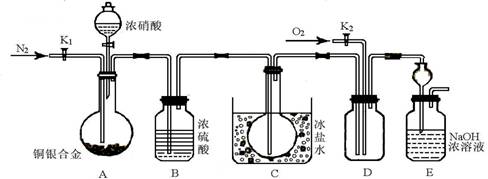
(1)写出A中Cu与HNO3反应可能的离子方程式 。
(2)实验前先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
(4)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L-1;实验后A溶液:V=40mL c(H+)=1.0 mol·L-1。假设反应中HNO3 既无挥发也无分解,则:①参加反应的HNO3的物质的量为 mol
②若已测出反应后E装置的生成物中含氮元素的质量m克,则为确定合金中Cu的质量分数还需测定的数据是 ,若测得该数据为n,写出合金中铜的质量(设为x克)的求算式子(只需列式子,不需解方程) 。
(5)为减小上述实验误差,在D中观察到实验现象后还须进行的操作是 。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。只利用A装置中反应后的溶液进行简单的操作,也可以确定合金中Cu的质量分数,其实验操作过程为
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com