
【题目】下列物质中,不属于合金的是( )
A. 水银 B. 钢铁 C. 硬铝 D. 黄铜
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于检测环境中NH3的含量,其工作原理示意图如下。

下列说法不正确的是
A. O2在电极b上发生还原反应
B. 溶液中OH+向电极a移动
C. 负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O
D. 反应消耗的NH3与O2的物质的量之比为4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键与化合物的叙述中,不正确的是
A.离子化合物中一定含有金属离子B.共价化合物一定不含离子键
C.氯化钙含有离子键,不含共价键D.离子化合物中可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从一种含银矿(含Ag、Zn、Cu、Pb及少量SiO2)中提取Ag、Cu及Pb的工艺流程如下:

(1)步骤①提高矿物中金属离子浸取率,除可改变盐酸的浓度和氯酸钾的量外,还可采取的措施是__________(写出两种即可)
(2)步骤②中试剂X为______ (填化学式,下同);步骤④滤渣的成分为_______。
(3)步骤③发生反应的化学方程式为____________________。
(4)步骤⑤发生反应的离子方程式为____________________;其中N2H4(肼) 的电子式为____。
(5)“还原”后的“滤液”经氧化后,其中的溶质主要为_______。
(6) 已知常温下,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。若在AgC1的悬浊液中加入NaCl 固体,AgCl 沉淀的溶解度_____ (填“升高”、“不变”或“降低”),往AgCl 的悬浊液中滴加NaI溶液,当AgCl 开始转化为AgI时,I-的浓度必须不低于_____mol/L (不用化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用。其中Ni-Cr-Fe合金是常用的电热元件材料。请回答:
(1) 基态Ni原子核外电子排布式为________;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为________ 。
(2) 金属Ni粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,该分子呈正四面体构型。试推断Ni(CO)4的晶体类型为_____,Ni(CO)4 易 溶于下列_____ (填选项字母) 中。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(3) FeO、NiO 晶体中r(Ni2+)和r(Fe2+)分别为69pm 和78pm,则熔点NiO__FeO(填“>"或“<”),原因为_________ 。
(4) 黄血盐是一种配合物,其化学式为K4[Fe(CN)6]·3H2O,该配合物中配体的化学式为_________,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为_________ 。
(5) 酸性K2Cr2O7能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为________。
(6) 在铬的硅酸盐中,SiO44-四面体如下图(a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中硅原子的杂化形式为_______,其化学式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫钠电池是一种以金属钠为负极、硫为正极、陶瓷管为电解质隔膜(作用是传递Na+)的二次电池,其原理可以表示为2Na+xS![]() Na2Sx 。现将该电池用于电化学法合成氨,电源两极分别连接两铂电极。下列有关说法错误的是
Na2Sx 。现将该电池用于电化学法合成氨,电源两极分别连接两铂电极。下列有关说法错误的是
A. 硫钠电池放电时负极反应为:Na-e-=Na+
B. 硫钠电池充电时,每生成1molNa转移xmol电子
C. 铂电极b为电解池阴极,电极反应式为N2+6e-+6H+=2NH3
D. 合成氨过程中H+经质子交换膜由a极向b极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示:

(1)Na2MoO4·2H2O中钼元素的化合价为______;
(2)焙烧时为了使钼精矿充分反应,可采取的措施是_______(答出一条即可);
(3)试配平焙烧过程中钼精矿发生的主要反应的化学方程式
为__MoS2+__O2![]() __MoO3+___SO2,该反应中氧化产物是________(填化学式)
__MoO3+___SO2,该反应中氧化产物是________(填化学式)
(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为___________;
(5)下图是碳钢在3种不同介质中的腐蚀速率实验结果:

①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是____。
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4—Fe2O3保护膜。
密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2。则NaNO2的作用是__。
(6)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
Lix(MoS2)n。则电池放电时的正极反应式是:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基础知识填空:
(1)氢氧化铁胶体制备的化学方程式_______________,所得分散系及下列物质分别用激光照射,与该分散系现象相同的是______。
A、淀粉溶液 B、澄清水 C、纳米铁 D、豆浆
(2)装置的选择:
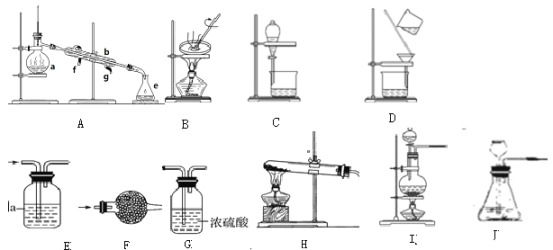
a、干燥氨气______。
b、分离植物油和水______。
c、检验CO中的是否含有CO2______。
d、分离碘和四氯化碳______。
e、实验室用氢氧化钙和氯化铵共热制氨气______。
f、实验室用稀盐酸和石制二氧化碳______。
(3)以物质的量为中心的计算
①、12.4gNa2X中含Na+0.4mol,则X的相对原子质量是______。
②、500mL质量分数为49%的硫酸溶液,密度为1.392g/cm3,则溶液的物质的量浓度为______________mol/L,其中含有SO42-的数目约为______(保留三位有效数字)。
(4)一定物质的量浓度溶液的配制:
①、实验室要配制480mL0.25mol·L-1的FeSO4溶液,需称量绿矾(FeSO4·7H2O)______g,
②、由于错误操作,使得实际浓度比所要求的偏小的是______(填写编号)。
A 称量绿矾时,左码右物
B 使用容量瓶配制溶液时,俯视液面定容,所得溶液的浓度
C 没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D 容量瓶刚用蒸馏水洗净,没有干燥
E 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F 把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
③、定容时,若加蒸馏水时不慎超过刻度线,处理方法是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com