
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、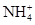 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、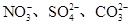 。已知:
。已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
回答下列问题:
(1)五种盐中,一定没有的阳离子是_________________________________________________;
所含的阴离子相同的两种盐的化学式是_____________________________________________。
(2)D的化学式为_________,D溶液显碱性的原因是(用离子方程式表示)________________。
(3)A和C的溶液反应的离子方程式是______________________________________________。
E和氨水反应的离子方程式是______________________________________________________。
(4)若要检验B中所含的阳离子,正确的实验方法是__________________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH、Ba2+、Al3+、Fe3+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 序号 | 实验内容 | 实验结果 |
| 1 | 加过量盐酸 | 无气体产生 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积),并有红褐色沉淀生成,将沉淀过滤洗涤、干燥、灼烧,称重得1.60 g固体。 |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量 | 第一次称量读数为2.33 g |
| 阴离子符号 | 物质的量浓度(mol·L-1) |
| | |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
1 L某混合溶液,可能含有的离子如下表。
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32—、AlO2— |
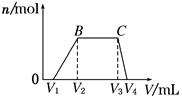
| Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
| n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
| n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)生产生活中广泛涉及氧化还原反应。
(1)工业上冶炼下列物质通常不采用电解法的是 。
a.Na b.Mg c.Fe d.Ag
(2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的 极,b极的电极反应式为 。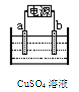
(3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为 ,X的化学式为 ,该反应的氧化剂和还原剂的物质的量之比为 。
(4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式 。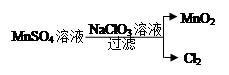
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
食盐和工业用盐具有广泛的用途。已知工业用盐主要成分为NaNO2,外观酷似食盐并有咸味。NaNO2有氧化性和还原性,遇酸分解放出NO2。
(1)下列试剂可鉴别工业用盐和食盐的是________。
a.H2O b.硝酸酸化的硝酸银 c.盐酸
(2)NaNO2与氢碘酸反应(含氮产物为NO)的离子方程式为______________。
(3)某工厂废液中含有2%~5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2中的氮转化为对空气无污染的气体,该物质是________。
a.NaCl b.NH4Cl c.浓H2SO4
(4)氯碱工业通过电解饱和食盐水来获得相应的产物。请写出电解食盐水的离子方程式______________________________________,
若在标准状况下生成3.36 L H2,则溶液中生成的OH-的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= ;
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4 c.(NH4)2SO4 d.(NH4)2SO3
其中c(NH4+)由大到小的顺序为 (填选项字母);
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 ;
②样品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g样品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-= 2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该样品中K2S2O8的质量分数为(杂质不参加反应) _(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 性,请写出工业上用氯气与NaOH溶液反应生产消毒剂NaClO的离子方程式 。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O和NaHCO3的离子方程式 。
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为 。
②ClO2遇浓盐酸会生成Cl2,每生成1 mol Cl2转移电子的物质的量为 。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为 。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4 mol HCl被氧化放出115.6 kJ的热量。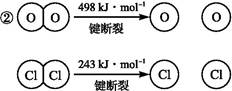
则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知在含HNO3的溶液中放入Al不生成H2;某无色溶液里,只含有下列11种离子中的几种:Mg2+、Fe3+、H+、Ag+、Ba2+、SO42-、HCO3-、OH-、MnO4-、NO3-、CO32-。已知该溶液能跟金属铝反应,且放出的气体只有氢气。试回答:
(1)若溶液跟铝反应只有AlO2-生成,则原溶液一定含有的大量的物质是________(填化学式),发生反应的离子方程式是_____________________________________________________,还可能含有的较多的物质是__________________(填化学式)。
(2)若溶液跟铝反应后有Al3+生成,则原溶液中可能(包括一定能)大量存在的离子是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有A、B、C、D四种溶液,它们是烧碱、硫酸、碳酸氢铵、氯化铜溶液中的某一种。各取少量,将其两两混合,其中A、B混合有蓝色絮状沉淀生成, C 与足量B或D混合均有无色气体产生。根据题意回答下列问题:
(1)B、C分别是 、
(2)向A中滴加B,离子方程式:
向C中滴加D,离子方程式:
(3)少量B和C混合,现象:________,离子方程式:_______________________________。
(4)上述三个反应均属于________________反应(填基本反应类型),反应发生的条件的不同点是 ;相同点是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com