
分析 (1)在2KNO3+3C+S═N2+K2S+3CO2反应中,S和N元素的化合价降低,被还原,S和KNO3为氧化剂,C元素的化合价升高,C为还原剂,从化合价变化的角度分析得失电子的数目和方向.
(2)氧化剂反应得到还原产物,还原剂被氧化得到氧化产物;
(3)先求出S的物质的量,再根据方程式计算.
解答 解:(1)在2KNO3+3C+S═N2+K2S+3CO2反应中,S和N元素的化合价降低,被还原,S和KNO3为氧化剂,C元素的化合价升高,C为还原剂,可用双线桥法表示为: ,
,
故答案为: ;
;
(2)S和KNO3为氧化剂被还原得到的K2S和N2为还原产物,C为还原剂被氧化得到的CO2为氧化产物;
故答案为:CO2;K2S和N2;
(3)硫的物质的量n=$\frac{32g}{32g/mol}$=1mol,
由反应方程式2KNO3+3C+S═N2+K2S+3CO2可知被氧化的碳单质物质的量是3mol;
故答案为:3.
点评 本题考查氧化还原反应,题目难度不大,本题中注意从化合价的角度分析氧化还原反应,注意双线桥法与单线桥法的区别.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+ )=c(HSO3-) | B. | c(H2SO3)>c(SO32-) | ||
| C. | c(Na+ )=c(SO32-)+c(HSO3-) | D. | c(Na+ )+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纯水的导电性很差,所以水不是电解质 | |
| B. | Na2O液态时能导电,所以Na2O是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | 溶于水或熔融状态下能导电的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
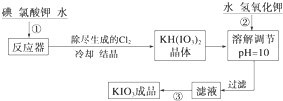
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取8.10mL稀盐酸 | |
| B. | 用pH计测得某溶液的pH为2.2 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com