
| A. | 乙炔通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色 | |
| B. | 甲苯在一定条件下与浓硝酸反应生成三硝基甲苯 | |
| C. | 乙醇在一定条件下与氢溴酸反应生成溴乙烷 | |
| D. | 在一定条件下苯与氢气反应制取环己烷 |
分析 A.乙炔含碳碳三键,能被高锰酸钾氧化;
B.苯环上H被硝基取代;
C.-OH被-Br取代;
D.苯环与氢气发生加成反应.
解答 解:A.乙炔含碳碳三键,能被高锰酸钾氧化,则乙炔通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色,为氧化反应,故A不选;
B.苯环上H被硝基取代,则甲苯在一定条件下与浓硝酸反应生成三硝基甲苯,为取代反应,故B不选;
C.-OH被-Br取代,则乙醇在一定条件下与氢溴酸反应生成溴乙烷,为取代反应,故C不选;
D.苯环与氢气发生加成反应,则在一定条件下苯与氢气反应制取环己烷,为加成反应,故D选;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应类型的判断,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的有机物称为醇 | B. | 能发生银镜反应的有机物都是醛 | ||
| C. | 苯酚俗称石炭酸,酸性比碳酸强 | D. | C3H6和C4H8不一定是同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在100℃、101 kPa条件下,液态水的汽化热为40.69 kJ•mol-1,则H2O(g)?H2O(l)△H=40.69 kJ•mol-1 | |||||||||||
| B. | 已知:
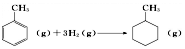 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 的焓变为△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]kJ•mol-1=-384 kJ•mol-1 | |||||||||||
| C. | 在一定条件下,某可逆反应的△H=+100kJ•mol-1,则该反应正反应活化能比逆反应活化能大100kJ•mol-1 | |||||||||||
| D. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400mL 2mol/L HCl | B. | 300mL 2mol/L H2SO4 | ||
| C. | 100mL 3mol/L HNO3 | D. | 500mL 18.4mol/L H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡.测得反应后溶液pH=0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
| 操作 | 现象 |
| 取2mL 5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊.测得反应后溶液pH=1.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1mol/L NaHSO3溶液中含有HSO3-离子数为0.1NA | |
| B. | 50 mL 18.4 mol•L-1浓硫酸与足量铜反应,生成SO2分子数为0.46 NA | |
| C. | 1 mol H2和1 mol I2充分反应,可得到HI分子数为2NA | |
| D. | 2.2 g CO2与足量镁粉反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol白磷中含共价键数均为4NA | |
| B. | 1 mol-CH3中含有的电子数为9 NA | |
| C. | 1 mol Na2O2 固体中含离子总数为4 NA | |
| D. | 标准状况下,2.24 L SO3所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
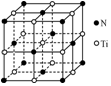 TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质.
TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com