
【题目】实验室用浓硫酸和乙醇制乙烯的装置如图所示,对下列操作或现象描述正确的是( )
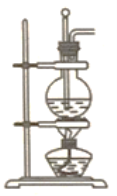
A. 圆底烧瓶中先加浓硫酸再加入乙醇
B. 实验得到的气体能使溴水褪色说明有乙烯生成
C. 反应中圆底烧瓶内会产生黑色固体
D. 用排水法或向下排空气法收集乙烯
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某研究小组以绿矾(FeSO47H2O)为原料制备化合物A[K3Fe(Ⅲ) (C2O4)xyH2O]并通过如下实验步骤确定A的化学式:
步骤1:准确称取A样品4.91g,干燥脱水至恒重,残留物质量为4.37g;
步骤2:将步骤1所得固体溶于水,经测定含Fe3+0.0l00mol;
步骤3:准确称取A样品4.91g置于锥形瓶中,加入足量的3. 00mol-L'1的H2SO4,溶液和适量蒸馏水,用0.500molL-1的KMnO4溶液滴定,当MnO4-恰好完全被还原为 Mn2+时,消耗KMnO4溶液的体积为24.00 mL。
请回答下列问题:
(1)绿矾(FeSO47H2O)若保存不当或长期放置,易与空气中的氧气反应,该反应中 FeSO4表现的性质为_____(填字母)。
A.氧化性 B.还原性 C.氧化性和还原性 D.酸性
(2)用物质的量浓度为18.0 molL-1的浓硫酸配制100mL3.00 molL-1的H2SO4溶液时,量取浓硫酸需要的量筒规格为_____(填字母)。
A.10mL B.25mL C.50mL D.l00mL
(3)步骤2发生的离子反应如下,将该离子方程式配平:_____MnO4-+_____ C2O42-+_____H+=_____Mn2++_____CO2↑+_____H2O。
通过计算确定化合物A中x、y的值(请写出计算过程)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表明吸附与解吸作用的过程如图所示,下列说法正确的是
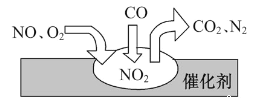
A. 反应中CO为氧化剂,N2为氧化产物
B. 催化转化总反应为2NO+O2+4CO![]() 4CO2+N2
4CO2+N2
C. NO和O2必须在催化剂表面才能反应
D. 汽车尾气的主要污染成分包括CO、NO和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式_____________________________________ 。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH______________ (填“大”、“小”或“相等”) 。
(3)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为_____________________________________ 。
(4)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为________________。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B. 室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C. 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D. 一定条件下反应N2+3H22NH3达到平衡时,3v正(H2)=2v逆(NH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组按如下流程,进行海带中碘含量的测定和碘的制取等实验。
I. 碘含量的测定

(1)步骤①是将海带置于__________中(填仪器名称)进行灼烧。
(2)步骤④是将溶液转移至________________(填定容仪器的名称)。
(3)取20.00mL 上述海带浸取原液,加稀H2SO4和足量KIO3,使![]() 和
和![]() 完全反应(
完全反应(![]() )。再以淀粉为指示剂,用
)。再以淀粉为指示剂,用![]() mol/L的Na2S2O3溶液滴定(
mol/L的Na2S2O3溶液滴定(![]() ),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
),当I2恰好完全反应时,用去Na2S2O3溶液20.00mL。
(4)判断用Na2S2O3溶液滴定恰好完全反应的现象是__________________________。
(5)计算该干海带中碘的质量分数_________________。
II. 碘的制取
另制海带浸取原液,按如下方案制取碘:
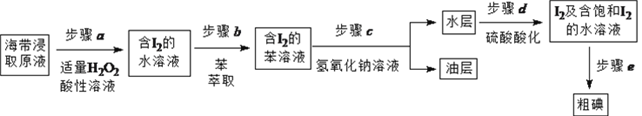
(1)补全步骤![]() 的反应方程式,配平并标出电子转移的数目和方向。
的反应方程式,配平并标出电子转移的数目和方向。
![]() ,_______________
,_______________
(2)步骤![]() 加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
加入足量NaOH溶液、振荡、静置后,油层在_____(填“上”或“下”)层,呈____色。
(3)步骤![]() 的操作是_______________。
的操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在潮湿空气中易水解氧化;见光则分解,变成褐色;CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。下图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)
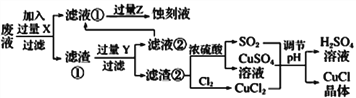
根据以上信息回答下列问题:
(1)写出生产过程中所用物质的名称:____________,________________。
(2)写出产生CuCl的化学方程式:________________________________。
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由________________________________________________。实际生产中SO2要适当过量,原因可能是___(答一点即可).
(4)得到CuC1晶体后,还需要经过水洗、乙醇洗涤两步操作。用乙醇洗涤的作用是________________。
(5)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为_________,当pH较大时CuCl产率变低原因是________________。
(6)氯化亚铜的定量分析:
①称取样品0.25g和过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.10molL-1硫酸铈标准溶液滴定。已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 | /tr>
则样品中CuCl的纯度为_______________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2O的摩尔质量为:_________ , 36 g 水的物质的量为:_____________如果将这36 水完全电解生成H2和 O2,则所得H2在标况下的体积约为:_________________
(2)1 mol Na2O2中所含阴离子数的个数约为:_________(用NA表示)
(3)将0.5 mol Na2CO3固体加水溶解配成250 mL溶液, c(Na+)=____ mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com