
(14分)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下: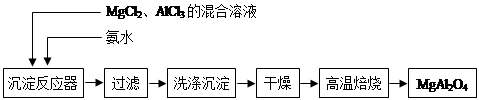
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如图所示,过滤操作中的一处错误是 。判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。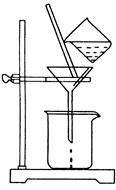
(3)在25℃下,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴 加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式 (已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。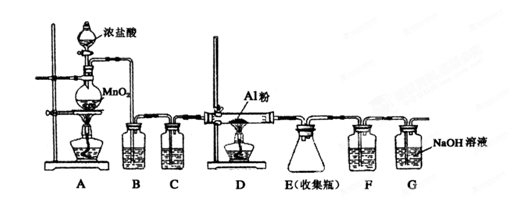
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ;F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
(5)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2 mol/L的NaOH溶液80 mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
(14分)(1)2Al(OH)3 + Mg(OH)2  MgAl2O4 + 4H2O(2分)
MgAl2O4 + 4H2O(2分)
(2)漏斗下端尖嘴未紧贴烧杯内壁(1分)AgNO3溶液(1分)坩埚(1分)
(3)Al(OH)3(1分) Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (2分)
(4)除去HCl(1分);吸收水蒸气(1分) 碱石灰(2分)
(5)4.00(2分)
解析试题分析:(1)MgCl2、AlCl3的混合溶液与氨水反应生成氢氧化镁和氢氧化铝沉淀,经过滤、洗涤、干燥后高温焙烧生成MgAl2O4,所以该反应的反应物是氢氧化镁和氢氧化铝,产物是MgAl2O4和水,化学方程式为2Al(OH)3 + Mg(OH)2  MgAl2O4 + 4H2O;
MgAl2O4 + 4H2O;
(2)过滤存在中符合“一贴二低三靠”过滤操作中的一处错误是漏斗下端尖嘴未紧贴烧杯内壁;氯化镁与氯化铝在与氨水反应生成沉淀时,沉淀上易附着有氯离子,检验氯离子所用的试剂是硝酸银溶液;高温焙烧时,用于盛放固体的仪器是坩埚;
(3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11>Ksp[Al(OH)3]=3×10-34。所以先生成溶解度小的沉淀Al(OH)3;生成Al(OH)3沉淀的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(4)因为无水AlCl3遇潮湿空气即产生大量白雾,所以制备氯化铝时要求氯气是干燥的,而且浓盐酸易挥发,挥发的HCl也与Al反应,所以需除去HCl,装置B中盛放饱和NaCl溶液,目的就是除去氯气中的HCl;装置C中盛放浓硫酸,目的是干燥氯气;F中也盛放浓硫酸,目的是吸收G中的水蒸气,防止水蒸气进入D中;可用一件仪器装填适当试剂后也可起到F和G的作用,该试剂既能吸收水,还能吸收多余的氯气,所以应该是碱石灰;
(5)Mg、Cu都是2价金属,沉淀的质量也即Mg、Cu的质量加上OH-的质量。该过程中生成NO气体0.896L(标准状况)物质的量是0.04mol,则Mg、Cu失去电子的物质的量等于NO3-得电子的物质的量也等于OH-的物质的量,即n(OH-)=0.04mol×3=0.12mol,所以沉淀的质量是1.96g+0.12mol×17g/mol=4g。
考点:考查镁、铝化合物的性质,化学方程式的判断与书写,装置的作用判断,氧化还原反应的计算


科目:高中化学 来源: 题型:单选题
某同学采用下图所示装置进行Fe粉与水蒸气的反应。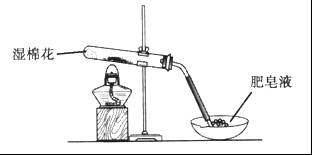
(1)写出Fe粉与水蒸气反应的化学方程式________________。
(2)该同学向反应后的固体中加入过量的稀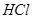 ,并将溶液分装在两支试管中。
,并将溶液分装在两支试管中。
①向第一支试管中滴加KSCN溶液,溶液呈红色,该溶液中存在的阳离子有______。
②向第二支试管中加入适量铁粉。该过程中发生化合反应的离子方程式是________。
再向所得溶液中滴加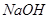 溶液并放置一段时间,该步反应中的实验现象是_________。
溶液并放置一段时间,该步反应中的实验现象是_________。
发生的氧化还原反应的化学方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属是一种重要的材料,人类的生产和生活离不开金属,下表表示了金属活动顺序表中铜、铁、锡、铝元素被人类大规模开发利用的大致年代。
33. 根据图中数据和有关化学知识,你认为金属大规模开发利用的先后顺序跟______有关(填写编号)。
a. 金属的导热性 b. 金属元素在地壳中的含量
c. 金属的活动性顺序 d. 金属的延展性
34. 钢铁的生产和使用是人类文明和进步的重要标志之一,请用化学方程式表示高炉炼铁的原理___________________________________________。
35. 比较铝、铁的活泼性,可用一个实验事实说明:__________________________________;
但是铝在空气中却表现出很强的抗氧化性,其原因是____________________________。
36. 复方氢氧化铝可以治疗胃酸过多,也能与强碱溶液反应, 写出氢氧化铝的电离方程式___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)铜及其化合物在生产、生活中有广泛的应用。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S + O2 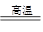 2Cu + SO2
2Cu + SO2
方法二:湿法炼铜:CuSO4 + Fe FeSO4 + Cu
FeSO4 + Cu
上述两种方法中,你认为哪种方法更好 ,原因是 (写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为 。
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下: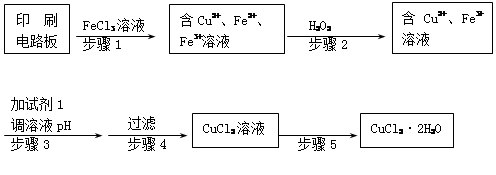
①步骤2中反应的离子方程式是 。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为
④步骤3中可选用的“试剂1”是 (写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为 [Ksp(Fe(OH)3)=4×10-38]。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验题(14分):Ⅰ、HCOOH是一种无色、易挥发的液体,某学习小组参照: 原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。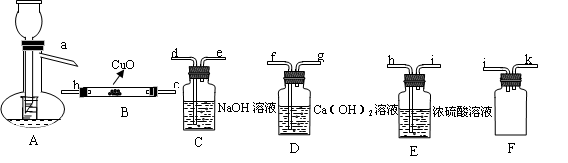
(1)若所制气体流向从左向右时,上述仪器连接为: A→( ) →( )→( )→( ) →( )
(2)A装置中小试管的作用(至少答两条):
① 。② 。
(3)证明HCOOH受热产物中有CO的现象为: 。
(4)本实验有3处用到酒精灯,除A、B处外,还缺一个酒精灯,应放在 处.
Ⅱ、学习小组查阅资料知:
Cu的颜色为红色或紫红色,而Cu2O的颜色也为红色或砖红色。②4CuO 2 Cu2O + O2↑;③ Cu2O +2H+
2 Cu2O + O2↑;③ Cu2O +2H+
= Cu+Cu2+ + H2O ;因此对CO充分还原CuO后所得红色固体是否含有Cu2O进行了认真的研究,提出下列设计方案:
方案①:取该红色固体溶于足量稀硝酸中,观察溶液颜色的变化。
方案②:取该红色固体溶于足量稀硫酸中,观察溶液颜色的变化。
(5)写出Cu2O与稀硝酸反应的化学方程式: 。
(6)请你评价方案②的合理性,并简述理由:方案②: ,理由: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E是常见化合物或单质,有如下转化关系(略去条件和副产品)。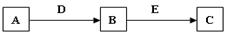
(1)若D为氧气,C为NaAlO2,试写出B转化为C的化学方程式 。
(2)若A为气态单质,B为漂白粉的有效成份,C具有漂白性。试写A转化为B的化学方程式 。画出组成单质A的元素原子结构示意图 。
(3)若A、B、C均为钠盐的水溶液,D、E均为卤素单质,请写出B转化为C的离子方程式 。
(4)若A常温下为固态单质,化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,且D、E为同一物质,则B为 。
(5)若B、D为质子数小于18的元素原子形成的单质,A、E、C均为氧化物,且D所含元素原子的质子数是B的2倍,A转化为B,B转化为C两个反应均属置换反应,请写出A转化为B的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
纯碱(化学式为Na2CO3)是一种重要的化工原料。现代化工生产有三种工艺:
一、布兰制碱法。以食盐为原料制碱,该法分三步:
①用氯化钠与硫酸反应制硫酸钠:2NaCl+H2SO4=Na2SO4+2HCl;
②用焦炭还原硫酸钠得硫化钠:Na2SO4+4C=Na2S+4CO↑
③用硫化钠与石灰石反应制碳酸钠:Na2S+CaCO3=Na2CO3+CaS
二、氨碱法即索尔维制碱法。以食盐、氨、二氧化碳为原料,其反应也分三步进行:
①NH3+CO2+H2O=NH4HCO3
②NH4HCO3+NaCl=NaHCO3+NH4Cl
③2NaHCO3=Na2CO3+CO2↑+H2O
三、候氏制碱法。低温下先向饱和食盐水中通入氨气,再通入二氧化碳可析出碳酸氢钠,再加入细盐末,因同离子效应,低温氯化铵溶解度突然降低,而食盐的溶解度变化不大,所以氯化铵析出而食盐不析出;再用氨饱和后通二氧化碳,结果往返析出NaHCO3和NH4Cl。该法生产的纯碱质量优良,纯白如雪。
(1)通过三种方法的比较,布兰制碱法工艺的缺点有 (写两点)。
(2)氨碱法工艺的中循环利用的物质是 (填化学式);产品的副产物NH4Cl既可以做氮肥又可以重新生成氨气。写出NH4Cl与生石灰反应的化学方程式 。
(3)候氏制碱法反应的方程式为 。
(4)为什么候氏制碱法工艺中先向饱和食盐水中通入氨气,再通入二氧化碳。理由是 (写两点)。
(5)候氏制碱法产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,用m1表示加热前纯碱样品的质量,m2表示加热后固体的质量。则纯碱中碳酸氢钠的质量分数可表示为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C
为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
(1)写出化学式:A________、D________、E________、X________。
(2)在反应①~⑦中,不属于氧化还原反应的是________(填编号)。
(3)反应⑥的离子方程式为:_______________________________________。
(4)反应⑦的化学方程式为_________________________________________;
该反应中每消耗0.3 mol的A,可转移电子______mol。
(5)写出D的溶液与小苏打溶液反应的离子方程式:_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com