
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
现有CO、CO2、O3(臭氧)三种气体,它们分别都含有1 mol氧原子,则三种气体的物质的量之比为( )
A.1:1:1 B.1:2:3 C.3:2:1 D.6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.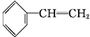 +Br2→
+Br2→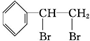 .
.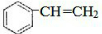 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
.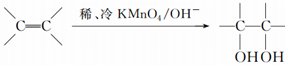 .请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式
.请写出A与稀、冷的KMnO4溶液在碱性条件下反应的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
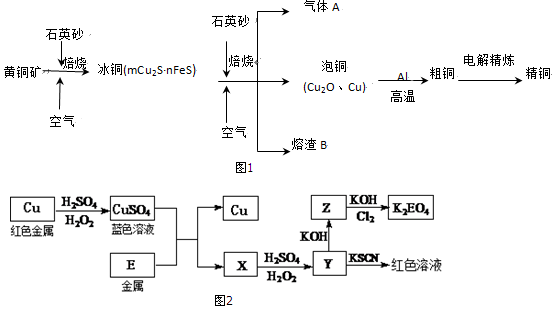
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:选择题
下列叙述中不正确的是( )
A.氢氧化钙的摩尔质量是74 g·mol1 B.阿伏加德罗常数是6.02×1023
C.1 mol H D.1 mol CO约含有6.02×1023个CO
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:实验题
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图6中选择称量NaOH固体所需要的仪器是(填字母): 。
Ⅱ.测定中和热的实验装置如图7所示。

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式 (中和热数值为57.3 kJ/mol):
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃[ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(3)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察右图,然后回答问题。
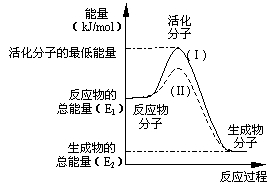
①图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=____________(用含E1、E2的代数式表示)。
②对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是_________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
在容积恒定的密闭容器中,一定量的SO2与1.1 mol O2发生反应:2SO2(g) + O2(g) 2SO3(g) △H<0。当气体的物质的量减少0.315 mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是
2SO3(g) △H<0。当气体的物质的量减少0.315 mol时,反应达到平衡,SO2的平衡转化率是90%。下列说法正确的是
A.相同条件下,平衡时若充入稀有气体,SO2的转化率增大
B.反应开始时,向容器中通入的SO2的物质的量是0.7 mol
C.保持其他条件不变, 仅降低温度,正反应速率减小程度比逆反应速率减小程度大
仅降低温度,正反应速率减小程度比逆反应速率减小程度大
D.保持其他条件不变,仅缩小容器体积,反应达到平衡时容器中有1.485 mol气体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上教学质检化学试卷(解析版) 题型:实验题

(1)写出下列仪器的名称:①____________,②____________,④____________。
(2)仪器①~④中,使用时必须检查是否漏水的是________________(填序号)。
(3)若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器____________,将仪器补充完整后进行的实验操作的名称为____________;②的进水口是____________(填“f”或“g”)。
(4)现需配制250mL、0.2 mol·L-1NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,指出图中的错误操作:______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西西藏民族学院附中高二上月考二化学卷(解析版) 题型:选择题
常温下,盐酸与氨水混合,所得溶液pH =7,则此溶液中( )
=7,则此溶液中( )
A.c(NH4+)<c(Cl-) B.c(NH4+)=c(Cl-)
C.c(NH4+)>c(Cl-) D.无法确定c(NH4+)与c(Cl-)的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com