
若20 g密度为ρ g·cm-3的硝酸钙溶液里含1 g Ca2+,则NO 的物质的量浓度是( )
的物质的量浓度是( )
A.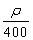 mol·L-1 B.
mol·L-1 B.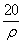 mol·L-1
mol·L-1
C.2.5ρ mol·L-1 D.1.25ρ mol·L-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某盐的混合物中含有0.2 mol/L Na+、0.4 mol/L Mg2+、0.4 mol/L Clˉ,则SO42ˉ为( )
A.0.1 mol/L B.0.2 mol/L C.0.3 mol/L D.0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+
B.加入K3[Fe(CN)6]溶液,产生特征蓝色沉淀,则原溶液一定有Fe3+
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO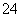
D.加入NaOH溶液,产生气体使湿润的红色石蕊试纸变蓝,则原溶液一定有NH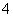
查看答案和解析>>
科目:高中化学 来源: 题型:
体积为V mL,密度为d g/mL,溶质的摩尔质量为M g·mol-1,物质的量浓度为c mol·L-1,溶质的质量分数为a%,溶质的质量为m g。下列式子正确的是( )
A.m=aV/100d B.c=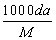
C.c=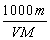 D.a%=
D.a%=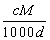 %
%
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型.回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下左图.下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是________.

(2)将NaBr溶液加入AgCl沉淀中,产生AgBr黄色沉淀.从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是________.
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
反应物从下列物质中选取:Na、Fe、H2O、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2(已知2Na+2H2O===2NaOH+H2↑).
| 错误观点 | 离子方程式 | |
| ① | 所有的离子方程式均可以表示一类反应 | |
| ② | 所有酸碱中和反应均可表示为:H++OH-===H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列氧化还原反应在溶液中均能发生。
①2Fe3++2I-=2Fe2++I2;②2Fe2++Br2=2Fe3++2Br-;③2Br-+Cl2=2Cl-+Br2。
(1)Fe2+、Br-、I-三种微粒按还原性由强到弱的顺序为____________________。
(2)现有某混合溶液中含a mol FeI2和b mol FeBr2,向该混合液中逐渐通入c mol Cl2,试根据以上化学原理分析,当只有I-被氧化时,c的取值范围是______________。
(3)某混合溶液中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4。向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com