
能表示阿伏加德罗常数数值的是( )
A.1 mol Na含有的电子数
B.标准状况下,22.4 L水所含的分子数
C.常温常压下,16 g氧气所含的原子数
D.1 L 1 mol·L-1硫酸溶液所含的H+数
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.向蒸馏水中滴加浓H2SO4时,KW不变
B.常温下,0.005mol·L-1Ba(OH)2溶液pH为12
C.NaHCO3水解的离子方程式为:HCO3- + H2O CO32- + H3O+
CO32- + H3O+
D.NaHSO3属于强碱弱酸盐,其水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
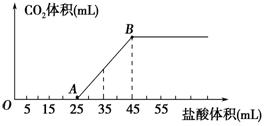
将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是( )
A.OA段发生反应的离子方程式为:H++OH-===H2O CO +H+===HCO
+H+===HCO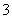
B.当加入35mL盐酸时,产生CO2的体积为224mL
C.A点溶液中的溶质为NaC1、NaHCO3
D.混合物中NaOH的质量0.60g
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中配制0.1 mol/L的硫酸铜溶液,下列操作正确的[ ]
A.取无水硫酸铜16 g溶于水配1 L溶液 B.取25 g胆矾溶于水配成1 L溶液
C.取16 g胆矾溶于1 L水中配成 D.取25 g胆矾溶于1 L水中
查看答案和解析>>
科目:高中化学 来源: 题型:
现有含NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的相互分离。相应的实验过程可用下图表示(提示:Na2CO3溶液呈碱性):
|
(1)写出上述实验过程中所用试剂为:
试剂1 ,试剂2 ,试剂4 。
(2)恰当地控制试剂4的加入量的方法是 。
(3)加入过量试剂3的目的是 。
(4)在加入试剂4后,获得固体D的实验操作④是 。(填操作名称)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中不正确的是( )
A.利用丁达尔效应可以区别溶液与胶体
B.在含有少量水的乙醇中加入氧化钙,然后蒸馏,可得到纯净的乙醇
C.用结晶法提纯混有少量氯化钠的硝酸钾
D.向某溶液中滴加盐酸无明显现象,再滴加氯化钡溶液产生白色沉淀,说明原溶液中含有CO
查看答案和解析>>
科目:高中化学 来源: 题型:
有BaCl2和NaCl混合溶液a L,将它平均分成两份,一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4,y mol AgNO3。据此得知原溶液的c(Na+)为( )
A.(y-2x)/a mol·L-1
B.(y-x)/a mol·L-1
C.(2y-2x)/a mol·L-1
D.(2y-4x)/a mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
为验证碳酸氢钠固体中是否含有碳酸钠,下列实验操作及判断正确的是( )
A.观察加热时能否放出气体
B.观察滴加盐酸时能否放出气体
C.溶于水中,滴加澄清石灰水,观察是否有沉淀生成
D.溶于水中,滴加少量氯化钡溶液,观察是否有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,辛烷的燃烧热为5 518 kJ·mol-1。下列热化学方程式书写正确的是( )
A.2H+(aq)+SO(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ·mol-1
B.KOH(aq)+1/2H2SO4(aq)===1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C.C8H18(l)+25/2O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ·mol-1
D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5 518 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com