
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
分析 有机物的分子式为C8H8O2,不饱和度为$\frac{2×8+2-8}{2}$=5,分子中含有苯环且属于酯,含有酯基,侧链可以为-OOCCH3,或为-COOCH3,或为-CH2OOCH,若是含有两个取代基,则可以是甲基和HCOO-,有邻、间、对三种.
解答 解:有机物的分子式为C8H8O2,不饱和度为$\frac{2×8+2-8}{2}$=5,分子中含有苯环且属于酯,含有酯基,若是只有一个侧链,侧链可以为-OOCCH3,或为-COOCH3,或为-CH2OOCH,若是含有两个取代基的侧链,则可以是甲基和HCOO-,有邻、间、对三种,共6种.
故选D.
点评 本题考查限制条件同分异构体书写,需要学生熟练掌握官能团的性质与转化,关键明确可能含有的官能团,要考虑位置异构、官能团异构,为易错题目.


科目:高中化学 来源: 题型:解答题
 铬、铁、镍、铜等金属及其化合物在工业上有重要用途.
铬、铁、镍、铜等金属及其化合物在工业上有重要用途.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(SO42-)>c(NH4+)>c(Al3+) | |
| B. | x=20时溶液导电能力比x=15时溶液导电能力强 | |
| C. | x=25时,溶液中主要有Ba2+、AlO2-,c(Ba2+)>c(AlO2-) | |
| D. | x=30时的离子方程式:NH4++Al3++2SO42-+2Ba2++5OH-→AlO2-+2BaSO4↓+NH3•H2O+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78 gNa2O2晶体中所含阴阳离子个数均为2NA | |
| B. | 1.5 g CH3+中含有的电子数为NA | |
| C. | 3.4 g氨中含有0.6NA个N-H键 | |
| D. | 常温下,100 mL1 mol•L-1AlCl3溶液中阳离子总数小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

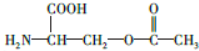 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 将乙醇与浓硫酸共热至l70℃,所得气体通入酸性KMnO4溶液中 | 酸性KMnO4溶液褪色 | 乙醇发生消去反应,气体中只含有乙烯 |
| B | 淀粉溶液和稀H2SO4混合加热,加新制Cu(OH)2悬浊液加热至沸腾 | 有砖红色沉淀产生 | 淀粉发生水解,产物有还原性 |
| C | 向甲苯中滴入适量浓溴水,振荡,静置 | 溶液上层呈橙红色, 下层几乎无色 | 甲苯和溴发生取代反应,使溴水褪色 |
| D | 在洁净的试管中加入2%硝酸银溶液1mL,逐滴加入2%稀氨水至沉淀恰好溶解为止,再滴加几滴乙醛,振荡后,放入热水浴中加热 | 试管壁出现光亮的银镜 | 乙醛发生了氧化反应,乙醛有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鼓励使用液化石油气做燃料 | B. | 鼓励使用太阳能、风能等能源 | ||
| C. | 鼓励煤火力发电,少用水力发电 | D. | 鼓励用私家车,少坐公交车出行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 棉、麻、蚕丝灼烧时只有无色无味的物质生成 | |
| B. | 酒精、汽油的危险品标志是 | |
| C. | 坚持饮用纯水,有利于人体健康 | |
| D. | 含氮量很髙的氨气,可直接作为农作物的优质氮肥施用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com