
工业上常用Fe作电极电解处理含Cr2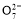 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )
的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )
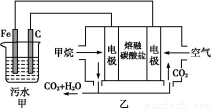
A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L
B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2=2C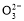
D.甲中阳极附近溶液中的离子反应方程式是:Cr2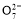 +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
A
【解析】乙为原电池,作电源用,甲为电解池。乙中甲烷一极为负极,空气一极为正极,则甲中Fe为阳极,C为阴极,A项由于未指明标准状况,气体体积无法计算;由图中乙中正极进入的物质为空气和CO2,知此两者为反应物,则电极反应为:O2+4e-+2CO2=2C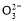 ,负极反应为:CH4-8e-+4C
,负极反应为:CH4-8e-+4C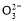 =5CO2+2H2O,C正确;B项,Na2SO4是电解质,可增强导电性,同时对污水中阴、阳离子的放电都没有影响,正确;甲中Fe溶解:Fe-2e-=Fe2+,生成的Fe2+具有还原性,所以将Cr2
=5CO2+2H2O,C正确;B项,Na2SO4是电解质,可增强导电性,同时对污水中阴、阳离子的放电都没有影响,正确;甲中Fe溶解:Fe-2e-=Fe2+,生成的Fe2+具有还原性,所以将Cr2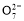 还原,依题干中信息知:该还原过程要消耗H+,形成Cr3+,进而形成Cr(OH)3沉淀,配平方程式即可,D正确。
还原,依题干中信息知:该还原过程要消耗H+,形成Cr3+,进而形成Cr(OH)3沉淀,配平方程式即可,D正确。


科目:高中化学 来源:2014高考化学名师知识点精编 专题18烃及其有机物的命名练习卷(解析版) 题型:选择题
某烯烃与H2加成后得到2,2 二甲基丁烷,该烯烃的名称是( )
二甲基丁烷,该烯烃的名称是( )
A.2,2 二甲基
二甲基 3
3 丁烯
丁烯
B.2,2 二甲基
二甲基 2
2 丁烯
丁烯
C.2,2
 二甲基
二甲基 1
1 丁烯
丁烯
D.3,3 二甲基
二甲基 1
1 丁烯
丁烯
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题14无机非金属材料-碳和硅练习卷(解析版) 题型:选择题
下列关于物质的性质与用途的说法中不正确的是( )
A.氧化铝的熔点很高,因此可用作耐火材料
B.某些金属氧化物灼烧时有特殊的颜色,因此可用于制造烟花
C.氢氟酸能与二氧化硅反应,因此可用于刻蚀玻璃
D.氯气具有强氧化性,因此可用于漂白有色布料
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题12钠、铝及其重要化合物练习卷(解析版) 题型:填空题
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3·3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。
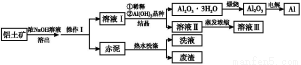
已知拜耳法生产Al2O3·3H2O的基本原理为:
Al2O3·3H2O+2NaOH(aq)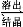 2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3·3H2O也可表示为2Al(OH)3]
(1)操作Ⅰ的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为 (任写三点)。
(3)用化学平衡理论解释稀释溶液Ⅰ有利于Al2O3·3H2O 结晶的原因 。
(4)为了析出Al2O3·3H2O,也可向溶液Ⅰ中通入过量CO2气体,写出生成Al2O3·3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液Ⅰ的稀释剂,请指出流程图中另一处类似的做法 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题12钠、铝及其重要化合物练习卷(解析版) 题型:选择题
利用下列实验装置,不能完成实验目的的是( )
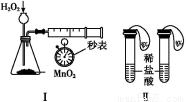
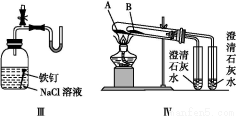
A.利用装置Ⅰ进行H2O2分解反应速率的定量测定
B.利用装置Ⅱ进行碳酸氢钠与碳酸钠的检验
C.利用装置Ⅲ证明铁生锈时空气参与反应
D.利用装置Ⅳ进行碳酸氢钠与碳酸钠稳定性强弱比较
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
用a、b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3)∶n(CuSO4)=1∶9]。t1时刻a电极得到混合气体,其中Cl2在标准状况下为224 mL(忽略气体的溶解);t2时刻Cu全部在电极上析出。下列判断正确的是( )
A.a电极与电源的负极相连
B.t2时,两电极的质量相差3.84 g
C.电解过程中,溶液的pH不断增大
D.t2时,b的电极反应是4OH--4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:填空题
如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
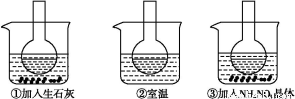
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是 。
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为 、 、 、 (填“左”、“右”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷B(解析版) 题型:选择题
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+ Fe2++Cr3+。下列说法一定正确的是( )
Fe2++Cr3+。下列说法一定正确的是( )
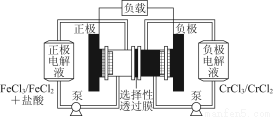
A.充电时,阴极的电极反应式为Cr3++e-=Cr2+
B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+
C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室
D.放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
下列有关说法正确的是( )
A.常温下,0.1 mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断增大,但无限接近7
B.25 ℃时,溶液中水电离出的c(H+)和水电离出的c(OH-)的乘积一定等于10-14
C.pH=6的纯水中,c(OH-)=10-8 mol·L-1
D.稀释0.01 mol·L-1的醋酸溶液时,溶液中所有的离子浓度均减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com