
【题目】(2015·上海)氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。
完成下列计算:
(1)CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2 L(标准状况)。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为 mol。
(2)已知粗盐水含MgCl2 6.80 mol/m3 , 含CaCl2 3.00mol/m3。
向粗盐水中加入Ca(OH)2除镁离子:MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2
然后加入Na2CO3除钙离子。处理上述粗盐水10 m3 , 至少需要加Na2CO3 g。
如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应: Ca2+ + 2NH3 + CO2 + H2O → CaCO3↓ + 2NH4+
处理上述10 m3粗盐水至少需要通入多少L(标准状况)碳酸化尾气?列式计算。
(3)某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。列式计算:
(1)过滤后溶液中氯化钠的质量。
(2)析出的碳酸氢钠晶体的质量。
【答案】
(1)20160;;400。
(2)10388;;54880。
(3)
(1) 351kg;(2)1680kg。
【解析】1. CaCO3分解的反应方程式是:CaCO3![]() CaO+CO2↑ , 根据方程式可知每1mol CaCO3反应会产生1mol CO2 , 质量分数为0.90的石灰石100 kg物质的量是n(CaCO3)= (1.0×105g×0.90)÷100g/mol=900mol,则石灰石完成分解产生标准状况下的CO2的体积是V(CO2)=nVm=900mol×22.4L/mol=20160L。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生标准状况下CO2 29120 L,如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭燃烧产生的CO2的体积是V(CO2)=V(总)-V(分解产生的CO2)= 29120 L-20160L=8960L,则其物质的量是n(CO2)= V(CO2) ÷Vm=8960L÷22.4L/mol=400mol。根据碳元素守恒,可知焦炭的物质的量与产生的物质的量CO2相等,也是400mol。
CaO+CO2↑ , 根据方程式可知每1mol CaCO3反应会产生1mol CO2 , 质量分数为0.90的石灰石100 kg物质的量是n(CaCO3)= (1.0×105g×0.90)÷100g/mol=900mol,则石灰石完成分解产生标准状况下的CO2的体积是V(CO2)=nVm=900mol×22.4L/mol=20160L。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生标准状况下CO2 29120 L,如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭燃烧产生的CO2的体积是V(CO2)=V(总)-V(分解产生的CO2)= 29120 L-20160L=8960L,则其物质的量是n(CO2)= V(CO2) ÷Vm=8960L÷22.4L/mol=400mol。根据碳元素守恒,可知焦炭的物质的量与产生的物质的量CO2相等,也是400mol。
2. 10 m3粗盐水中含有的MgCl2、CaCl2 物质的量是:n(MgCl2)= 6.80 mol/m3×10 m3=68mol;n(CaCl2)= 3.00mol/m3×10 m3=30mol。根据反应方程式MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2可知1mol MgCl2发生反应被除去时引入1mol CaCl2.则向粗盐水中加入Ca(OH)2除镁离子后得到的溶液中含有的CaCl2的物质的量是:68mol+30mol=98mol,根据反应方程式:Na2CO3+ CaCl2=CaCO3↓+2NaCl可知反应消耗Na2CO3的物质的量与CaCl2的物质的量相等,则其质量是m(Na2CO3)=nM=98mol×106g/mol=10388g。根据反应方程式Ca2+ + 2NH3 + CO2 + H2O → CaCO3↓ + 2NH4+可知反应消耗的氨气与CO2的物质的量的比是2:1,而混合气体中含NH3体积分数为0.100、CO2体积分数0.040,说明NH3过量,不能完全反应,应该以不足量的CO2为标准进行计算,而n(Ca2+)=n(CO2),n(Ca2+)=98mol,则需要n(CO2)= 98mol,混合气体的物质的量是n(混合)= 98mol÷0.04=2450mol,其在标准状况下的体积是V(混合)=nVm= 2450mol×22.4L/mol=54880L。21教育网
3.(1)n(NaCl)(总)=m÷M=1521000g÷58. 5g/mol=26000mol,反应产生的NH4Cl的物质的量是n(NH4Cl)= m÷M=1070 000g÷53. 5g/mol=20000mol,根据氯元素守恒可知,在溶液中含有的NaCl的物质的量是n(NaCl)= n(NaCl)(总)- n(NH4Cl)= 26000mol-20000mol=6000mol,其质量是m(NaCl)=nM=6000mol×58. 5g/mol=351000g=351kg。21*cnjy*com
(2)氨盐水中发生反应根据反应方程式:NaCl+CO2+NH3+H2O= NaHCO3↓+NH4Cl。产生的NaHCO3的物质的量与NH4Cl的物质的量相等,则析出的碳酸氢钠晶体的质量是m(NaHCO3)=nM=20000mol×84g/mol=1680000g=1680kg。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】“民以食为天,食以安为先”.下列做法会危害食品安全的是( )
A.回收餐桌废油加工成化工原料
B.给蔬菜瓜果喷洒甲醛溶液
C.在熟食中加适量的食品添加剂
D.食盐加碘、酱油加铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.再加入10mL pH=11的NaOH溶液,混合液pH=7
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中 ![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·上海)白云石的主要成份是CaCO3·MgCO3 , 在我国有大量的分布。以白云石为原料生产的钙镁系列产品有广泛的用途。白云石经煅烧、水化后得到钙镁的氢氧化物,再经过碳化实现Ca2+、Mg2+的分离。碳化反应是放热反应,化学方程式如下:Ca(OH)2 + Mg(OH)2 + 3CO2 CaCO3 + Mg(HCO3)2 + H2O。
完成下列填空。
(1)Ca(OH)2的碱性比Mg(OH)2的碱性 (选填“强”或“弱”), Ca(OH)2的溶解度比Mg(OH)2的溶解度 (选填“大”或“小”)
(2)碳化温度保持在50~60℃。温度偏高不利于碳化反应,原因是 、 。温度偏低也不利于碳化反应,原因是 。
(3)已知某次碳化时溶液中钙离子浓度随时间的变化如右图所示,在10 min到13 min之内钙离子的反 应速率为 。15 min之后钙离子浓度增大,原因是 (用化学方程式表示)。
(4)Mg原子核外电子排布式为 ;Ca原子最外层电子的能量 Mg原子最外层电子的能量。(选填“低于”、“高于”或“等于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·上海)氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空: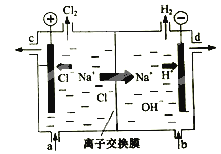
已知: H2SO3 Ki1=1.54×10-2 Ki2=1.02×10-7
HClO Ki1=2.95×10-8
H2CO3 Ki1=4.3×10-7 Ki2=5.6×10-11
(1)写出电解饱和食盐水的离子方程式。
(2)离子交换膜的作用为: 、 。
(3)精制饱和食盐水从图中 位置补充,氢氧化钠溶液从图中 位置流出。(选填“a”、“b”、“c”或“d”)
(4)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2 , 还生成CO2和KHSO4等物质。
写出该反应的化学方程式
(5)室温下,0.1 mol/L NaClO溶液的pH 0.1 mol/L Na2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。
浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,SO32–、CO32–、HSO3–、HCO3– 浓度从大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应(夹持仪器略去)。

(1)A中装有氯化铵和氢氧化钙的混合物,发生反应的化学方程式是___________;
(2)B中加入的是碱石灰,其作用是___________;
(3)实验时C中观察到的现象是___________,发生反应的化学方程式是_____________;
(4)试管D中收集到的物质是___________,向其中滴加酚酞试液,溶液变_____色,原因是___________________(用电离方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com