
分析 (1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定溶液颜色变化;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,也可根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)第②步中的氧化还原反应为亚铁离子被重铬酸钾氧化生成铬离子和亚铁离子,根据电荷守恒和元素守恒书写离子方程式;
(4)根据Ksp=c(Cr3+)•c3(OH-)来计算氢氧根离子离子的浓度,并计算氢离子浓度和pH的大小;
(5)阳极是活性电极时,阳极本身失电子,生成阳离子;
(6)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀.
解答 解:(1)c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
(2)对于平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,
a.当2v正(Cr2O${\;}_{7}^{2-}$)═v逆(CrO${\;}_{4}^{2-}$)时,说明正逆反应速率相等,故反应处于平衡状态,故a正确;
b.Cr2O72-和CrO42-的浓度相同,不一定平衡,故b错误;
c.溶液的颜色不变,即有色离子浓度不会再不变,达到了化学平衡状态,故c正确;
故答案为:ac;
(3)第②步中的氧化还原反应为亚铁离子被重铬酸钾氧化生成铬离子和亚铁离子,反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:1、6、14H+、6、2、7H2O;
(4)Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,则需c(OH-)=$\root{3}{\frac{Ksp}{c(Cr{\;}^{3+})}}$=$\root{3}{\frac{10{\;}^{-32}}{10{\;}^{-5}}}$=10-9mol/L,所以c(H+)=10-5mol/L,即pH=5,
故答案为:5;
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,故答案为:阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
(6)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑;同时大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀;
故答案为:2H++2e-=H2↑;Fe(OH)3.
点评 本题主要考查了铬及其化合物的性质、氧化还原反应、沉淀溶解平衡和电化学知识等内容,难度中等,抓住题目信息是解题的关键,注意把握氧化还原反应原理以及溶度积在计算中的应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
下列关于物质分类的说法正确的是
①稀豆浆、硅酸、氯化铁溶液都属于胶体
②氯水、次氯酸都属于弱电解质
③Na2O、MgO、Al2O3均属于碱性氧化物
④明矾、冰水混合物、四氧化三铁都不是混合物
⑤电解熔融的Al2O3、12C转化为14C都属于化学变化
⑥葡萄糖、油脂都不属于有机高分子
A.①② B.②④ C.③⑤ D.④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温 | B. | 加压 | C. | 增加D的量 | D. | 加入催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x+y<n | B. | 该化学平衡向正方向移动 | ||
| C. | B的转化率增大 | D. | C的体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
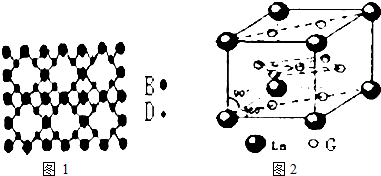 现有A、B、D、E、F、G六种前四周期元素,它们的原子序数依次增大,E、F同主族,A、B的最外层电子数之和与D的最外层电子数相等,A、D、E的质子数之和与F的原子序数相等,A能分别与B、D、E形成电子总数相等的分子.E、F均能形成多种同素异形体,G2+的3d能级有8个电子.
现有A、B、D、E、F、G六种前四周期元素,它们的原子序数依次增大,E、F同主族,A、B的最外层电子数之和与D的最外层电子数相等,A、D、E的质子数之和与F的原子序数相等,A能分别与B、D、E形成电子总数相等的分子.E、F均能形成多种同素异形体,G2+的3d能级有8个电子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
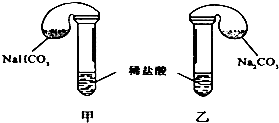 某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:
某次化学兴趣小组活动上,三组学生分别用图示甲、乙两装置,探究“NaHCO3和Na2CO3与稀盐酸的反应”,按表中的试剂用量,在相同条件下,将两个气球中的固体粉末同时倒入试管中(装置的气密性已检查) 请回答:| | 试剂用量 | 实验现象 (气球体积变化)) | 分析原因 |
| 第 ① 组 | 42 g NaHCO3 53 g Na2CO3 300mL4 mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42 g NaHCO3 53 g Na2CO3 300mL3 mol/L盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .(不考虑空间构型)
.(不考虑空间构型)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 | |
| B. | 硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ | |
| C. | 硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- | |
| D. | 取少量硫酸亚铁铵晶体放入试管,加入浓氢氧化钠溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com