【答案】
分析:A、根据电解质溶液中离子的放电判断溶质的变化,从而得出其浓度的变化.
B、根据溶液中离子的放电判断溶液的酸碱性变化,注意计算①、②中硫酸的浓度,才能得出其pH值的相对大小.
C、根据溶液中离子的放电确定两极上的生成物,从而确定生成气体的体积大小.
D、根据溶液中离子的放电顺序及与电子的关系计算电极上析出固体的质量大小.
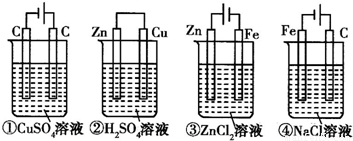
解答:解答:①为电解池,反应方程式为2CuSO
4+2H
2O

2Cu+O
2↑+2H
2SO
4,每生成1mol O
2,转移4mol电子,消耗2mol CuSO
4,反应后,溶液pH降低.
②为原电池,锌为负极,Zn-2e
-=Zn
2+,铜为正极2H
++2e
-=H
2↑每生成1mol H
2,转移,2mol电子,消耗1mol H
2SO
4,溶液pH升高.
③为电镀池,阳极反应是阳极金属失去电子而被氧化成阳离子;阳极Zn-2e
-=Zn
2+,阴极反应是溶液中的Zn
2+得电子的还原反应,Zn
2++2e
-=Zn溶液中Zn
2+浓度不变.
④为电解池,反应方程式为2NaCl+2H
2O

H
2↑+2NaOH+Cl
2↑每生成1mol H
2,转移2mol电子,消耗NaCl为2 mol,反应后,溶液pH升高.
A.当溶液的体积均为250mL,开始时电解质溶液的浓度均为0.10mol/L,工作一段时间后,测得导线上均通过0.02mol电子,①消耗CuSO
4为0.01 mol,②消耗0.01mol H
2SO
4,③ZnSO
4溶液的浓度不变.④消耗NaCl为0.02 mol.故A错误;
B.④反应后,溶液pH升高.消耗NaCl为0.02 mol.生成0.02 mol NaOH,溶液呈碱性.③Zn
2+浓度不变,Zn
2+水解,溶液略呈酸性.碱性④>③;
②溶液pH升高,但仍呈酸性,剩余0.025mol-0.01 mol=0.015 mol H
2SO
4.①反应后,溶液pH降低,呈酸性,生成0.01 mol H
2SO
4,酸性:②>①;①的溶液是酸性溶液,③是盐溶液,酸性较弱,所以pH值③>①;通过以上分析知,工作一段时间后溶液的pH:④>③>①>②,故B正确.
C.导线上均通过0.02mol电子.①产生0.005mol O
2.②产生0.01mol H
2.③产生气体为0.④产生0.01mol H
2和0.01mol Cl
2.产生气体的总体积:④>②>①>③,故C错误.
D.导线上均通过0.02mol电子.①电极上析出0.01mol Cu固体质量为0.64克,②电极上析出的固体的质量为0.③铁电极上析出0.01mol Zn固体的质量为0.65克.④电极上析出的固体的质量为0.电极上析出的固体的质量:③>①>②=④.故D错误.
故选B.
点评:本题主要考查了原电池的反应原理、电解池电解原理及其应用.做题时要正确写出电极方程式,准确判断两极上离子的放电顺序是解本题的关键.

 2Cu+O2↑+2H2SO4,每生成1mol O2,转移4mol电子,消耗2mol CuSO4,反应后,溶液pH降低.
2Cu+O2↑+2H2SO4,每生成1mol O2,转移4mol电子,消耗2mol CuSO4,反应后,溶液pH降低. H2↑+2NaOH+Cl2↑每生成1mol H2,转移2mol电子,消耗NaCl为2 mol,反应后,溶液pH升高.
H2↑+2NaOH+Cl2↑每生成1mol H2,转移2mol电子,消耗NaCl为2 mol,反应后,溶液pH升高.




