
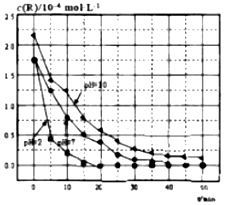
| A. | 对比pH=7和pH=10的曲线,在同一时刻,能说明R的起始浓度越大,降解速率越大 | |
| B. | 对比pH=2和pH=7的曲线,说明溶液酸性越强,R的降解速率越大 | |
| C. | 在0~20min之间,pH=2时R的平均降解速率为0.0875×10-4mol•L-1•min-1 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |
分析 A.反应速率为平均速率,不是瞬时速率;
B.对比pH=2和pH=7的曲线,酸性强的斜率较大;
C.根据v=$\frac{△c}{△t}$计算;
D.根据图中的信息可以知道在0-50min之间,pH=2和pH=7时R的降解百分率.
解答 解:A.反应速率为平均速率,不是瞬时速率,则不能说明在同一时刻,能说明R的起始浓度越大,降解速率越大,故A错误;
B.对比pH=2和pH=7的曲线,可知溶液酸性越强,即pH越小,线的斜率越大,可以知道R的降解速率越大,故B正确;
C.v=$\frac{△c}{△t}$=$\frac{1.75×1{0}^{-4}mol/L}{20min}$=0.0875×10-4mol•L-1•min-1,故C正确;
D.根据图示可知:在0-50min之间,pH=2和pH=7时R的降解百分率都为100%,故D正确.
故选A.
点评 本题考查了化学平衡的影响因素,为高频考点,题目难度中等,明确图象曲线变化的含义为解答关键,注意掌握外界条件对化学平衡、化学反应速率的影响,试题培养了学生的分析能力及灵活应用能力.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 5:3 | C. | 33:11 | D. | 11:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| C. | 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,还能沉降水中的悬浮物 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片和半导体器件的制造 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁带燃烧可以用CO2灭火 | |
| B. | 单晶硅是重要的半导体材料,常用于制造光导纤维 | |
| C. | Cl2能使湿润的有色布条褪色,是因为Cl2的氧化性 | |
| D. | 金属钠可保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋清溶于水所得澄清液体无丁达尔现象 | |
| B. | 棉、麻、丝、毛完全燃烧都只生成CO2和H2O | |
| C. | 中国瓷器闻名世界,陶瓷的主要成分是SiO2 | |
| D. | 人体内的酶通常通过降低反应的活化能来加快对应反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y与Z位于同一周期 | B. | 单质氧化性:Y<W | ||
| C. | W的氢化物具强还原性 | D. | lmol C中含有离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
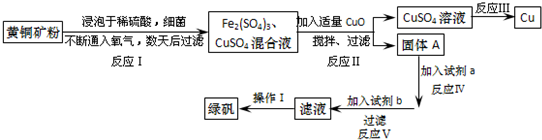
| Fe2+ | Cu2+ | Fe3+ | |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
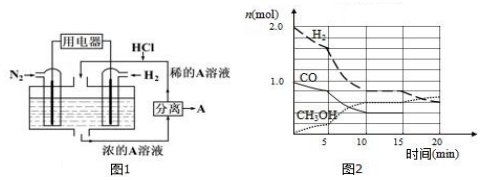
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com