
【题目】FeCl3具有净水作用,而高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,处理污水比FeCl3高效。请回答下列问题:已知25℃,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3
(1)FeCl3净水的原理是______。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为______(填写数值)。
(2)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=______molL-1。
(3)FeCl3在溶液中分三步水解:
Fe3++H2OFe(OH)2++H+ K1
Fe(OH)2++H2O![]() +H+ K2
+H+ K2
![]() +H2OFe(OH)3+H+ K3
+H2OFe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_________。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() +yH+,欲使平衡正向移动可采用的方法是(填序号)__________。
+yH+,欲使平衡正向移动可采用的方法是(填序号)__________。
a.降温 b.加水稀释 c. 加入NaHCO3d.加入NH4Cl
(4)从环境保护的角度看,制备Na2FeO4较好的方法为电解法,其装置如图所示:
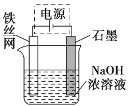
①电解过程中阳极的电极反应式为______。
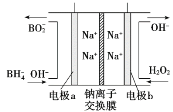
②图甲装置中的电源采用NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电源工作原理如图所示。电极a与甲池中_______(填“石墨”或“铁丝网”)连接,电极b的反应式为________。
【答案】Fe3++3H2OFe(OH)3(胶体)+3H+ 2.5×10-5 4×10-5 K1>K2>K3 b c Fe+8OH--6e-=![]() +4H2O 石墨 H2O2+2e-=2OH-
+4H2O 石墨 H2O2+2e-=2OH-
【解析】
(1)Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,可起到净水的作用,离子方程式为:Fe3++3H2OFe(OH)3(胶体)+3H+,该反应平衡常数K=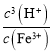 =
=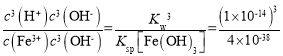 =2.5×10-5;
=2.5×10-5;
(2)25℃时pH=3的溶液中,c(H+)=10-3mol/L,则c(OHˉ)=10-11mol/L,c(Fe3+)=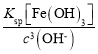 =
=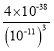 mol/L=4×10-5 mol/L;
mol/L=4×10-5 mol/L;
(3)由于前一步的水解会对后一步的水解产生抑制作用,所以三级水解程度依次减小,即K1>K2>K3;
a.水解为吸热反应,降温平衡逆向移动,故a不符合;
b.“越稀越水解”,加水稀释可以使平衡正向移动,故b符合;
c.加入碳酸氢钠,电离出的碳酸氢根与氢离子结合促进铁离子的水解,故c符合;
d.铵根水解产生氢离子,会使平衡逆向移动,故d不符合;
综上所述选bc;
(4)①铁丝网与电源正极相连为阳极,根据题意可知Fe失电子被氧化成![]() ,所以电极反应式为Fe+8OH--6e-=
,所以电极反应式为Fe+8OH--6e-=![]() +4H2O;
+4H2O;
②据图可知电极b上H2O2转化为OHˉ,O元素被还原,所以b电极为电池的正极,电极反应为H2O2+2e-=2OH-,电极a为电池负极,与甲池中的石墨连接。


科目:高中化学 来源: 题型:
【题目】25℃时,下列说法正确的是
A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=a+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液pH<7
C.NH4Cl溶液的Kw大于NaCl溶液的Kw
D.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中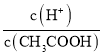 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子电池的应用很广,其正极材料可再生利用。某离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为:6C+xLi++xe-=LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件末给出)。
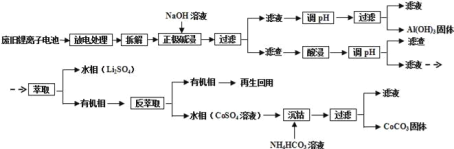
(1) LiCoO2中,Co元素的化合价为____________。
(2)写出“正极碱浸”中发生反应的离子方程式_____________________________________。
(3)采用H2SO4和H2O2的混合液进行“酸浸”,一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式:__________________________________________。可用盐酸代替H2SO4和H2O2的混合液,但缺点是___________________________。
(4)写出“沉钴“过程中发生反应的化学方程式_________________________________。
(5)充放电过程中,发生LiCoO2与LixCoO2之同的转化,写出放电时电池反应方程式_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,①pH=11的氨水;②pH=11的NaOH溶液;③pH=3的醋酸;④pH=3的硫酸,下列有关说法不正确的是
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①、④两溶液混合后,若溶液呈中性,则所得溶液中2c(NH4+)=c(SO42-)
D.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=11:9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A.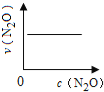 B.
B.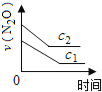 C.
C.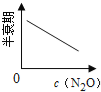 D.
D.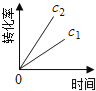
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。
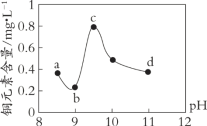
查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I (aq)![]() (aq)。该反应的化学平衡常数K 随着温度的升高而减小。下列说法正确的是( )
(aq)。该反应的化学平衡常数K 随着温度的升高而减小。下列说法正确的是( )
A.反应 I2(aq)+I (aq)![]() (aq)的 ΔH>0
(aq)的 ΔH>0
B.利用上述反应,可以在碘量法滴定过程中加入过量 KI 以减少 I2 的挥发损失
C.在 I2 的 KI 溶液中加入CCl4,平衡不移动
D.一定温度下,向 I2 的KI 溶液中加入少量 KI 固体,化学平衡正向移动,平衡常数K 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池在放电过程中,负极质量增加,正极质量也增加
B.金属铝的冶炼流程为:铝土矿![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3![]() 无水AlCl3
无水AlCl3![]() Al
Al
C.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀,但加热反应剧烈
D.一定条件下,使用催化剂能加快反应速率但不提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随Cr含量的变化三种稀酸对Fe﹣Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
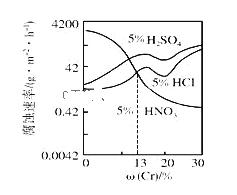
A.稀硝酸对Fe﹣Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.随着Cr含量增加,稀硝酸对Fe﹣Cr合金的腐蚀性减弱
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe﹣Cr合金的腐蚀性最强
D.酸对Fe﹣Cr合金的腐蚀与阴离子浓度无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com