
 有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):NN键为942、O=O键为500、O-H键为463,则断裂1mol N-H键所需的能量是( )
有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):NN键为942、O=O键为500、O-H键为463,则断裂1mol N-H键所需的能量是( )| A. | 658 | B. | 516 | C. | 391 | D. | 194 |
分析 根据热化学方程式的含义可知:旧键断裂所吸收的能量和新键生成所释放的能量之差即为化学反应焓变的数值,结合图示内容来回答即可.
解答 解:根据图中内容,可以看出4NH3(g)+3O2(g)=4N(g)+12H(g)+6O(g),△H3=3340kJ/mol-276kJ/mol=3064kJ/mol,化学反应的焓变等于产物的能量与反应物能量的差值,旧键断裂吸收能量,新键生成释放能量,
设断裂1molN-H键所需的能量为K,旧键断裂吸收的能量:4K+500×3=3064,解得K=391.
故选C.
点评 本题考查学生化学键的断裂和生成与反应的吸放热之间的关系,考查学生知识的灵活应用情况,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 相同物质的量的OH-和CH3+含有相同数目的电子 | |
| B. | 25℃时,pH=13的1.0 LBa(0H)2溶液中含有的OH-数目为0.2NA | |
| C. | 标准状况下,2.24LCl2通入足量H2O或NaOH溶液中转移的电子数均为0.2NA | |
| D. | 常温常压下,4.4gCO2和N2O混合物中所含有的原子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
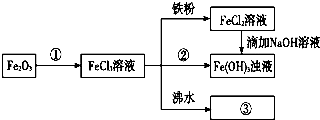
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 铁片放入过量的稀硝酸中:3Fe+8H++2NO3-═3Fe2++2NO2↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | NH4+和Fe2+ | C. | Al3+和Mg2+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 酸 | 电离常数 |
| 碳酸 | K1=4×10-7 K2=5.6×10-11 |
| 亚硫酸 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | SO2+H2O+2CO32-═2HCO3-+SO32- | B. | SO2+H2O+CO32-═H2CO3+SO32- | ||
| C. | 2SO2+2H2O-+CO32-═H2CO3+2HSO3- | D. | SO2+H2O+CO32-═HCO3-+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1=1mol•L-1 | B. | 2c1>c2 | C. | 2ω1<ω2 | D. | $\frac{{c}_{1}}{{ω}_{1}}$<$\frac{{c}_{2}}{{ω}_{2}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
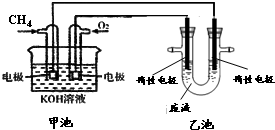 氯化铁溶液常作印刷电路铜板的腐蚀剂,得 到含有Cu2+等的废液,有人提出可以利用如图的装置从得到的废液中提炼金属铜.该过程中甲池负极的电极反应式是CH4+10OH--8e-=CO32-+7H2O,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为1.12L(假设气体全部逸出).
氯化铁溶液常作印刷电路铜板的腐蚀剂,得 到含有Cu2+等的废液,有人提出可以利用如图的装置从得到的废液中提炼金属铜.该过程中甲池负极的电极反应式是CH4+10OH--8e-=CO32-+7H2O,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为1.12L(假设气体全部逸出).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com