
| A. | 共价化合物中各原子最外层都一定满足8电子结构 | |
| B. | BaO2晶体中阳离子与阴离子数目之比为1:2 | |
| C. | H2O是一种非常稳定的化合物,这是由氢键所致 | |
| D. | 在反应2Na2O2+2H2O═4NaOH+O2↑中,既有离子键、极性键和非极性键的断裂,又有离子键、极性键和非极性键的形成 |
分析 A、共价化合物中不一定各原子都满足最外层8电子稳定结构;
B、BaO2晶体中阳离子是钡离子与阴离子是过氧根离子数目之比为1:1;
C、氢键影响物质的物理性质,如溶沸点、密度等,化学键可以影响物质的物理性质,还可以影响物质的化学性质,如键能越大物质越稳定;
D、在反应2Na2O2+2H2O═4NaOH+O2↑,既有钠离子与过氧根离子之间的离子键、氢氧之间的极性键和过氧根离子中氧氧之间的非极性键的断裂,又有钠离子与氢氧根离子之间的离子键、氢氧根离子中氧氢极性键共价键和氧气分子中氧氧非极性键的形成.
解答 解:A、共价化合物中不一定各原子都满足最外层8电子稳定结构,如氢化物,故A错误;
B、BaO2晶体中阳离子是钡离子与阴离子是过氧根离子数目之比为1:1,故C错误;
C、由于氢氧键的键能较大,所以水是一种非常稳定的化合物,故C错误;
D、在反应2Na2O2+2H2O═4NaOH+O2↑,既有钠离子与过氧根离子之间的离子键、氢氧之间的极性键和过氧根离子中氧氧之间的非极性键的断裂,又有钠离子与氢氧根离子之间的离子键、氢氧根离子中氧氢极性键共价键和氧气分子中氧氧非极性键的形成,故D正确;
故选D.
点评 本题主要考查了氢键、离子晶体中微粒的数目等,难度不大,根据课本知识即可完成即可.


科目:高中化学 来源: 题型:选择题
| A. | 一定含有Mg2+、Al3+、Clˉ,可能含有Na+,不含NH4+ | |
| B. | 一定含有Mg2+、Clˉ,不含NH4+,可能含有Na+、Al3+ | |
| C. | c (Clˉ) 为 4.00 mol•L-1,c(Al3+)为5.00 mol•L-1 | |
| D. | c (Mg2+) 为 1.00 mol•L-1,c(Na+)为 0.5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2分解产生1molO2,转移的电子数为4NA | |
| B. | 1.00mol NaCl中,所有Na+的最外层电子总数约为8 NA | |
| C. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 标准状况下,2.24LCH4所含电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
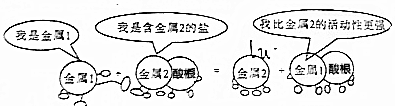
| A. | 此反应不可能是复分解反应 | |
| B. | 若金属1是锌,金属2可能是银 | |
| C. | 还原性:金属1>金属2 | |
| D. | 若金属2为铜,则反应过程中生成2mol金属2,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:填空题
由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式: 。已知H2O(l) = H2O(g) ΔH = +44 kJ·mol-1 ,则标准状况下33.6 L H2 生成液态水时放出的热量是 kJ 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:选择题
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A.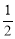 N2H4(g)+
N2H4(g)+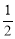 O2(g)=
O2(g)=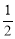 N2(g)+H2O(g) ΔH=+267 kJ·mol-1
N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH =-534 kJ·mol-1
C.N2H4(g)+O2(g)==N2(g)+2H2O(g) ΔH =+534 kJ·mol-1
D.N2H4(g)+O2(g)==N2(g)+2H2O(l) ΔH =-133.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
如图是课外活动小组设计的用化学电源使LED灯发光的装置。下列说法错误的是
A.铜片表面有气泡生成
B.装置中存在“化学能→ 电能→ 光能”的转换
C.如果将硫酸换成柠檬汁,导线中不会有电子流动
D.如果将锌片换成铁片,电路中的电流方向不变
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
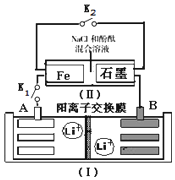 如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )
如图装置(Ⅰ)为一种可充电锂离子电池的示意图,该电池充、放电的化学方程式为:Li4Ti5O12+3Li$?_{充电}^{放电}$ Li7Ti5 O12.装置(Ⅱ)为电解池的示意图.当闭合K1,断开K2时,Fe电极附近溶液先变红.下列说法正确的是( )| A. | 闭合K1,断开K2时,若将Fe电极和石墨电极互换,装置(Ⅱ)中发生的总反应为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑ | |
| B. | 闭合K1,断开K2时,当0.1 mol Li+从A极区迁移到B极区,理论上Fe电极上产生的气体体积为1.12 L(标准状况下) | |
| C. | 取下锂离子电池充电,电极A为阳极,发生还氧化反应,电极上发生的电极反应式为:Li7Ti5O12-3e-═Li4Ti5O12+3 Li+ | |
| D. | 若开始时,断开K1,闭合K2,一段时间后,石墨电极附近显红色,则该电极反应为:2H++2e-═H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com