
| A. | 镁铝合金既可完全溶于过量盐酸又可完全溶于过量NaOH溶液 | |
| B. | 在加入铝粉能放出氢气的溶液中,K+、NH4+、CO32-、Cl-一定能够大量共存 | |
| C. | 氯化铝溶液中加入过量氨水反应的实质:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 依据铝热反应原理,能发生反应2Al+3MgO$\frac{\underline{\;高温\;}}{\;}$3Mg+A12O3 |
分析 A.Mg和NaOH不反应;
B.加入铝粉能生成气体的溶液呈强碱性或酸性,但必须是弱氧化性酸;
C.氢氧化铝易溶于强碱但难溶于弱碱;
D.镁的活泼性大于Al.
解答 解:A.镁和铝都易和HCl反应生成氯化物和氢气,但Mg不能和NaOH反应,铝能和氢氧化钠反应,所以镁铝合金不能完全溶于NaOH溶液中,故A错误;
B.加入铝粉能生成气体的溶液呈强碱性或酸性,但必须是弱氧化性酸,酸性条件下不能大量存在碳酸根离子,碱性条件下不能存在大量铵根离子,故B错误;
C.氢氧化铝易溶于强碱但难溶于弱碱,氨水是弱碱溶液,所以氢氧化铝不溶于氨水,氯化铝和一水合氨反应离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故C正确;
D.镁的活泼性大于Al,所以不能采用铝热反应冶炼Mg,要采用电解氯化镁方法冶炼镁,故D错误;
故选C.
点评 本题考查镁、铝及其化合物的性质,涉及两性氢氧化物的性质、金属冶炼、离子共存、铝的性质等知识点,明确元素化合物知识是解本题关键,C选项是实验室制取氢氧化铝的反应原理,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | C4H10的二氯取代物有4种 | |
| B. | 最简式为C2H5的烃结构简式有5种 | |
| C. | 乙苯的一氯取代物只有3种 | |
| D. | 分子式为C4H10O且与钠反应的有机物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+)<c(CH3COO-) | |
| B. | 将pH=a的醋酸稀释为pH=a+1的过程中,$\frac{{cCH}_{3}COOH}{{cH}^{+}}$变小 | |
| C. | 浓度均为0.1 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-) | |
| D. |  向10.00 mL 0.1 mol•L-1HCOOH溶液中逐滴加入0.1 mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化),则c点NaOH溶液的体积小于10 mL 向10.00 mL 0.1 mol•L-1HCOOH溶液中逐滴加入0.1 mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化),则c点NaOH溶液的体积小于10 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
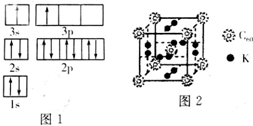 纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料等已应用到社会生活和高科技领域.单位质量的A和B单质燃烧时均放出大量热,可用作燃料.已知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能(KJ•mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1541 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
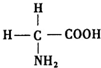 氨基酸是蛋白质的基石,甘氨酸是最简单的氨基酸(结构如图),在甘氨酸分子中,N原子的杂化形式是sp3,在甘氨酸分子中C、N、O原子的第一电离能从大到小的顺序是N>O>C;氮可以形成多种离子,如N3-、NH2-、NH4+、N2H5+等,其中,NH4+的空间构型是正四面体.
氨基酸是蛋白质的基石,甘氨酸是最简单的氨基酸(结构如图),在甘氨酸分子中,N原子的杂化形式是sp3,在甘氨酸分子中C、N、O原子的第一电离能从大到小的顺序是N>O>C;氮可以形成多种离子,如N3-、NH2-、NH4+、N2H5+等,其中,NH4+的空间构型是正四面体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
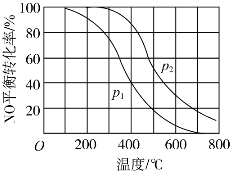
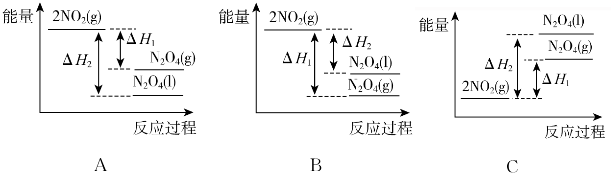
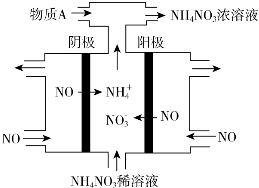
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com