
| A. | ⑤⑧ | B. | ⑤⑥⑦⑧ | C. | 均不可 | D. | ① |
分析 与溴水发生氧化还原反应,或溴水中氢离子反应,促进溴与水反应正向进行,或发生萃取,则溴水颜色变浅,以此来解答.
解答 解:①KCl晶体与溴水不反应,溴水颜色不变浅,故选;
②H2S气体与溴水发生氧化还原反应,溴水颜色变浅,故不选;
③溴易溶于CCl4,发生萃取,溴水颜色变浅,故不选;
④Mg与溴水反应,溴水颜色变浅,故不选;
⑤溴水与NaOH发生氧化还原反应,溴水颜色变浅,故不选;
⑥溴水中氢离子与反应Na2CO3,溴水颜色变浅,故不选;
⑦Na2SO3具有还原性,可与溴水发生氧化还原反应,溴水颜色变浅,故不选;
⑧FeBr2具有还原性,可与溴水发生氧化还原反应,溴水颜色变浅,故不选;
故选D.
点评 本题考查物质的性质,为高频考点,把握发生的氧化还原反应、复分解反应及萃取等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
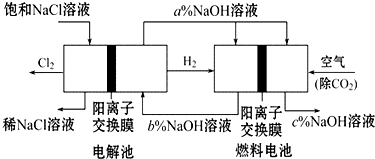 有一种节能的氯碱工业新工艺,将电解池与燃料电池相结合,相关流程如图(电极未标出).回答下列有关问题:
有一种节能的氯碱工业新工艺,将电解池与燃料电池相结合,相关流程如图(电极未标出).回答下列有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| B. | 海水蒸发制海盐的过程中发生了化学变化 | |
| C. | 利用潮汐发电是将化学能转化为电能 | |
| D. | 从海水中可以得到NaCl,电解熔融NaCl可制备金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
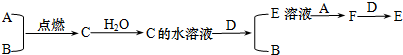
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:4 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com