
【题目】下图三条曲线表示不同温度下水的离子积常数,下列说法不正确的是
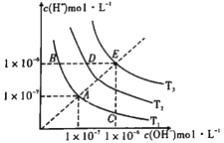
A. 图中温度:T3>T2>T1
B. 图中pH关系是:pH(B)=pH(D)=pH(E)
C. 图中五点Kw间的关系:E>D>A=B=C
D. C点可能是显酸性的盐溶液
【答案】D
【解析】A.水的电离是吸热反应,升高温度促进水电离,则水中c(H+)、c(OH-)及离子积常数增大,根据图知,离子积常数T3>T2>T1,所以温度T3>T2>T1,故A正确;B.水的离子积常数只与温度有关,温度越高,离子积常数越大,同一曲线是相同温度,根据图知,温度高低点顺序是B<D<E,但三点溶液的氢离子浓度相等,则pH相等,故B正确;C.温度高低点顺序是A=B=C<D<E,水的离子积常数只与温度有关,温度越高,离子积常数越大,Kw间的关系:E>D>A=B=C,故C正确;D.C点时,Kw=1×10-14,c(OH-)=1×10-6,溶液的pH=8,显碱性,故D错误;


科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是______________;(填序号),配制上述溶液还需用到的玻璃仪器是______________(填仪器名称);

(2)配制NaOH时,在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度______0.1mol/L(填“大于”、“等于”或“小于”).
(3)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_____________mL(计算结果保留一位小数).在实验中其他操作均正确,若用量筒量取浓硫酸时仰视刻度线,则所得配得溶液浓度_____________0.5mol/L(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示是由3个圆所构成的类别关系图,其中I为大圆,II和III分别为大圆之内的小圆。下列选项中符合这种类别关系的是( )

A. I: DNA II: RNA III:核酸
B. I:还原性糖 II:果糖 III:蔗糖
C. I:固醇 II:胆固醇 III:维生素D
D. I:蛋白质 II:酶 III:激素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是
A. 此法的优点之一是原料来源丰富
B. ①②③步骤的目的是从海水中获取MgCl2
C. 提取镁的过程涉及化合、分解、置换反应
D. 第④步电解时,还会产生副产品氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四只盛有相同量NaOH溶液的烧杯中通入不同量的CO2气体,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图:(忽略CO2的溶解和HCl的挥发),则下列分析都正确的组合是

对应图象 | 溶液中的主要成分 | |
A | Ⅰ | NaOH、NaHCO3 |
B | Ⅱ | NaHCO3、Na2CO3 |
C | Ⅲ | NaOH、Na2CO3 |
D | Ⅳ | Na2CO3 |
A. A. B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下几种可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集该雾霾,并经必要的预处理后得试样溶液,设计并完成了如下的实验。请根据以下的实验操作与现象,判断该同学得出的结论不正确的是
已知:3NO3-+8Al+5OH-+2H2O=3NH3↑+8AlO2-

A. 试样中一定存在NH4+、Mg2+、SO42-和NO3-
B. 气体1和气体2成分一定相同
C. 试样中可能含有Al3+
D. 该雾霾中可能存在NH4NO3、NaCl和MgSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类中,前者是电解质,后者是非电解质的组合是( )
A.NaCl、Cl2
B.NaHCO3、蔗糖
C.Ba(OH)2、HCl
D.H2SO4、盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分Co2O3),含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取草酸钴(CoC2O3)的工艺流程如下:

已知:ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱。
(1)“550℃焙烧”的目的是__________
(2)“浸出液”的主要成分是_________
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为___________。
(4)“净化除杂1”过程中,先在40℃-50℃加入H2O2,其作用是_______(离子方程式表示):再升温至80-85℃,加入Na2CO3溶液,调pH至4.5以达到净化除杂的目的。
(5)为测定产品的纯度,将1g产品用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液。
已知NH3·H2O的Kb=1.76×10-5;H2C2O4的Ka1=5.9×l0-2,Ka2=6.4×10-5。
①判断NH4HC2O4溶液呈________(填“酸性”、“碱性”或“中性”)。
②将草酸钴溶液用过量稀硫酸酸化.用0.1000mol/LKMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液20.00mL,则草酸钴样品的纯度为____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种白色固体:①氯化钠②氯化钡③无水硫酸铜④硫酸钠,不使用其它试剂(可以用水)就可以把它们区分开,区分出的先后顺序是( )
A.②③④①B.②④③①C.③①④②D.③②④①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com