
 һ���¶��£�ij�ݻ�Ϊ2L���ܱ������ڣ�ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯��������ͼ��ʾ��
һ���¶��£�ij�ݻ�Ϊ2L���ܱ������ڣ�ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯��������ͼ��ʾ������ ��1��M���ʵ�������N�����ʵ�����С����NΪ��Ӧ�MΪ���������N�����ʵ��������Ҳ�Ϊ0����÷�Ӧ���ڿ��淴Ӧ���������ʵ���֮�ȵ��ڻ�ѧ������֮��ȷ����ѧ��������������д��Ӧ����ʽ��
��2�����Է�Ӧ����ƽ��״̬ʱ��������������ȣ�����ֵ����ʵ������䣻
0-t2 ʱ����ڡ�n��N��=8mol-4mol=4mol���ٸ���v=$\frac{��c}{��t}$����v��N����
��3�����º����£����ݷ���ʽ�ж�ѹǿ�仯�������ѹǿ�淴Ӧ�����仯����ѹǿ����ʱ˵������ƽ�⣬��ѹǿ���䣬����˵����Ӧ����ƽ�⣻
��4�������¶ȡ�����ѹǿ���������ʵ�Ũ�ȡ�ʹ�ô����ȿ��Լӿ췴Ӧ���ʣ�
��� �⣺��1��M���ʵ�������N�����ʵ�����С����NΪ��Ӧ�MΪ���������N�����ʵ��������Ҳ�Ϊ0����÷�Ӧ���ڿ��淴Ӧ����n��N��=8mol-2mol=6mol����n��M��=5mol-2mol=3mol����N��M�Ļ�ѧ������֮��Ϊ2��1���ʷ�Ӧ����ʽΪ��2N?M��
�ʴ�Ϊ��2N?M��
��2����t3ʱ��M��N�����ʵ���Ϊ��ֵ������ƽ��״̬������t3ʱ��v��=v����
0-t2 ʱ����ڡ�n��N��=8mol-4mol=4mol����v��N��=$\frac{\frac{4mol}{2L}}{{t}_{2}min}$=$\frac{2}{{t}_{2}}$mol/��L��min����
�ʴ�Ϊ��t3��=��$\frac{2}{{t}_{2}}$mol/��L��min����
��3����Ӧ����ʽΪ��2N?M����Ӧǰ���������ʵ�������ȣ����º����£��淴Ӧ��������ѹǿ�����仯��ѹǿ����˵����Ӧ����ƽ�⣬
�ʴ�Ϊ���ܣ�
��4��A�������¶ȣ���Ӧ���ʼӿ죬��A��ȷ��
B������ѹǿ����Ӧ���ʼ�������B����
C����СM��Ũ�ȣ���Ӧ���ʼ�������C����
D������Ӧ���������С��ѹǿ����Ũ������Ӧ���ʼӿ죬��D��ȷ��
��ѡ��AD��
���� ���⿼�黯ѧƽ����㡢ƽ��״̬��������Ӧ���ʼ��㼰Ӱ�����أ��Ƚϻ�����ע���ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����ٱ仯˵������ƽ�⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʹ��̪��Һ������Һ��Na+��Cl-��SO42-��Fe3+ | |
| B�� | ʹ��ɫʯ����Һ������Һ��Fe2+��Mg2+��CO32-��Cl- | |
| C�� | ̼��������Һ��K+��SO42-��Cl-��H+ | |
| D�� | pH��7����Һ��K+��Ba2+��Cl-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
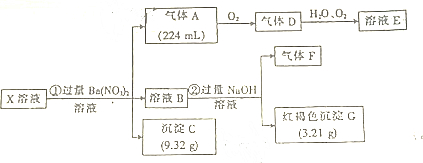
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��a=b��pH��NaX����pH��NaY���������ԣ�HX��HY | |
| B�� | ��a=b�������c��X-��=c��HY��+c��Y-������HX��ǿ�� | |
| C�� | ��a��b��c��X-��=c��Y-�������Ƴ����ԣ�HX��HY | |
| D�� | ������Һ�������ϣ����c��X-��+c��HX��+c��HY��+c��Y-��=0.1mol•L-1��������a=b=0.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
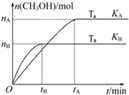 һ�������£����ݻ�Ϊ3L���ܱ������м���1molCO��2molH2������Ӧ��CO��g��+2H2��g��?CH3OH��g����H����ƽ��״̬������ͼʾ�ش�
һ�������£����ݻ�Ϊ3L���ܱ������м���1molCO��2molH2������Ӧ��CO��g��+2H2��g��?CH3OH��g����H����ƽ��״̬������ͼʾ�ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��t��ʱ����2mol SO2��1mol O2ͨ�����Ϊ2L�ĺ��º����ܱ������У��������·�Ӧ��
��t��ʱ����2mol SO2��1mol O2ͨ�����Ϊ2L�ĺ��º����ܱ������У��������·�Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ȼ���ȡ�H=-890.3kJ/mol�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g���TCO2��g��+2H2O��g����H=-890.3 kJ/mol | |
| B�� | һ�������£���0.5 mol N2��1.5 molH2�����ܱ������г�ַ�Ӧ����NH3����19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��?2NH3��g����H=-38.6 kJ/mol | |
| C�� | ��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8 kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2��g��+O2��g���T2H2O��l����H=-571.6 kJ/mol | |
| D�� | HCl��NaOH��Ӧ���к��ȡ�H=-57.3 kJ/mol����H2SO4��Ba��OH��2��Ӧ���к��ȡ�H=2����-57.3��kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��һ�����ܣ�Al��Mg | B�� | ˮ���ԣ�CH3CH2OH��CH3CH2OCH2CH3 | ||
| C�� | �е㣺HCl��HF | D�� | �����ܣ�NaCl��MgO |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com