
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
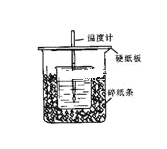
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___。
(2)烧杯间填满碎纸条的作用是___。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大、偏小、无影响”)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等、不相等”),所求中和热___(填“相等、不相等”)。
(5)用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会___;(填“偏大”、“偏小”、“无影响”)。
【答案】环形玻璃搅拌棒 减少实验过程中的热量损失 偏小 不相等 相等 偏小
【解析】
根据中和热的测定实验原理、操作步骤与操作的规范性分析作答。
(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会有热量散失,导致测得反应混合液的温度将偏低,则求得的中和热数值偏小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.50molL-1盐酸与50mL0.55molL-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等;
(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2O中含有的电子数为10NA
B.NO2和N2O4混合气体共46 g,所含原子数为3NA
C.1 mol Na2O2中含有的阴离子数为2NA
D.常温常压下,12 g 14C所含原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用盖斯定律可计算一些不易测定的反应的反应热。
(1)已知在298K时下述反应的有关数据:C(s) +![]() O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
O2(g)=CO(g) △H1=-110.5 kJ·mol-1,C(s) + O2(g)=CO2(g) △H2=-393.5 kJ·mol-1。则C(s) + CO2(g)=2CO(g) 的△H为__________________。
(2)火箭发射时可用肼(N2H4)为燃料,以二氧化氮作氧化剂,它们相互反应生成氮气和水蒸气。
已知:N2(g) + 2O2(g)=2NO2(g) △H=+67.7 kJ·mol-l;
N2H4(g) + O2(g)=N2(g) + 2H2O(g) △H=-534 kJ·mol-l。
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期中的四种主族元素A、B、C、D、E,原子序数依次增大。A是电负性最大的元素,B、D的价电子层中均有两个未成对电子,回答下列问题:
(1)B元素在周期表中的位置为___________________________;
(2)A的基态原子中,电子占据的最高能级符号为___;该能级的电子云轮廓图形状为__________;
(3)B、C、D三种元素的第一电离能大小顺序为________;该电离能大小变化的原因为________________;
(4)C、D、E三种元素的最高价氧化物的水化物的酸性强弱顺为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。则下列说法不正确的是

A. 在100℃时,M的化学式为FeSO4·4H2O
B. FeSO4·7H2O晶体中有4种不同结合力的水分子
C. FeSO4·H2O存在的最高温度为373℃
D. 380℃的P加热至650℃时的化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示。
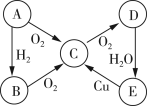
(1)如果A是淡黄色固体,回答下列问题。
①写出A、E的化学式:A________、E________。
②C→D的化学方程式为____________。
③将足量的物质C通入BaCl2溶液中,下列说法正确的是________(填字母序号)。
a.溶液中出现白色沉淀
b.溶液没有明显变化
c.若继续通入Cl2或NH3,则溶液中均出现白色沉淀
(2)如果A是无色气体,回答下列问题。
①D→E的化学方程式为_______。
②E→C的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有![]() 、
、![]() 、
、![]() 三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4,②1s22s22p63s23p3,③1s22s22p5。则下列有关比较中正确的是
三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4,②1s22s22p63s23p3,③1s22s22p5。则下列有关比较中正确的是![]()
A. 第一电离能:![]()
B. 简单离子半径:![]()
C. 电负性:![]()
D. 最高价氧化物对应水化物的酸性:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com