
����Ŀ��������������(FeC2O4��2H2O��M=180g/mol)�ʵ���ɫ��������ɹ����ͼ��ijʵ��С����������һϵ��̽����
��.�����������������ȷֽ�����̽��
��1���������ɷֵ�̽����С���Ա������ͼװ�ý���ʵ�飺
A.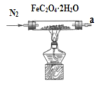 B.
B. C.
C. D.
D. E.
E.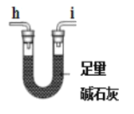
�ٰ������������ҵķ�������װ�õĽӿ�˳��Ϊa��g��f��___��β������װ�ã��������ظ�ʹ�ã���
�ڼ��װ�������Ժ���ͨ��һ��ʱ��N2����Ŀ��Ϊ__��
��ʵ��֤������������к���CO�����ݵ�ʵ������Ϊ__��
�ܽ���ʵ��ʱ��Ϩ��A��C���ľƾ�����ֹͣͨ��N2����Ŀ����__��
��2��С���Ա���ʵ��֤����A�зֽ��Ĺ���ɷ�ΪFeO���������������ֽ�Ļ�ѧ����ʽΪ__��
��3��ɹ����ͼʱ���������������Ǹй������ʧȥ�ᾧˮת��ΪFeC2O4������K3[Fe(CN)6]��ҺΪ��ɫ��������ɫ��Ӧ�Ļ�ѧ����ʽΪ__��
��.��������������Ʒ���ȵIJⶨ
��ҵ�ƵõIJ������������г�����FeSO4���ʣ��ⶨ�䴿�ȵIJ������£�
����1����ȡmg��������������Ʒ������ϡH2SO4�У����250mL��Һ��
����2��ȡ������Һ25.00mL����cmol��L-1KMnO4��Һ�ζ����յ㣬���ı�ҺV1mL��
����3����Ӧ����Һ�м�������п�ۣ���ַ�Ӧ��������ϡH2SO4������cmol��L-1KMnO4����Һ�ζ����յ㣬���ı�ҺV2mL��
��4������2�еζ��յ������Ϊ__������3�м���п�۵�Ŀ��Ϊ___��
��5��������![]() ������Һʱ����Fe2+���������ʣ���ⶨ�����__������ƫ��������ƫ����������������
������Һʱ����Fe2+���������ʣ���ⶨ�����__������ƫ��������ƫ����������������
���𰸡�b��c��h��i(��i��h)��d��e((��e��d)��b��c �ž�װ���еĿ�������ֹ����ʵ�飨����ը���������ļ��飩 c�й����ɺ�ɫ��Ϊ��ɫ����Bװ���г��ֻ��� ��ֹ���� FeC2O4��2H2O![]() FeO+CO��+CO2��+2H2O 3FeC2O4+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2+3K2C2O4 ��ƿ����Һ��ɫ��Ϊdz��ɫ����dz��ɫ������
FeO+CO��+CO2��+2H2O 3FeC2O4+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2+3K2C2O4 ��ƿ����Һ��ɫ��Ϊdz��ɫ����dz��ɫ������![]() �ڲ���ɫ ��Fe3+��ԭΪFe2+ ƫ��
�ڲ���ɫ ��Fe3+��ԭΪFe2+ ƫ��
��������
I����A�в�����������(FeC2O4��2H2O)���ȷ����ֽⷴӦ��FeC2O4��2H2O![]() FeO+CO��+CO2��+2H2O����D����ˮ�����Ĵ��ڣ���B����CO2���壬Ȼ����E����CO����CO��ͨ��CʹCO��CuO������Ӧ��CO+CuO
FeO+CO��+CO2��+2H2O����D����ˮ�����Ĵ��ڣ���B����CO2���壬Ȼ����E����CO����CO��ͨ��CʹCO��CuO������Ӧ��CO+CuO![]() CO2+Cu����Ӧ������CO2����ͨ��Bװ�ü��飬���ڷ�Ӧ��������CO�������ᵼ�´�����Ⱦ����������������β����������K3[Fe(CN)6]��Һ������Һ�е�Fe2+���ݴ���д��Ӧ����ʽ��
CO2+Cu����Ӧ������CO2����ͨ��Bװ�ü��飬���ڷ�Ӧ��������CO�������ᵼ�´�����Ⱦ����������������β����������K3[Fe(CN)6]��Һ������Һ�е�Fe2+���ݴ���д��Ӧ����ʽ��
II������2����FeC2O4��2H2O��FeSO4�ܽ���������Һ�е�������KMnO4��Һ����Һ�е�Fe2+��H2C2O4����������Fe2+��ΪFe3+��KMnO4����ԭΪ��ɫ��Mn2+��H2C2O4��ΪCO2�����ݳ�������3����Ӧ����Һ�м�������п�ۣ�Zn����Һ��Fe3+��ԭΪFe2+����ַ�Ӧ��������ϡH2SO4������ cmol/L KMnO4����Һ�ζ����յ㣬��ʱ��Һ��Fe2+����ΪFe3+�����ı�ҺV2mL����ǰ���������ĵĸ��������Һ��������������H2C2O4���ĵ����������C�غ��֪n(H2C2O4)=n(FeC2O4��2H2O)�������ݵ����غ�ȷ��KMnO4��FeC2O4��2H2O�����ʵ���֮��Ĺ�ϵ�����ø÷�Ӧ���ĵ�n(KMnO4)�����FeC2O4��2H2O���������Ӷ��ɵ��䴿�ȣ��ݴ˷�����
��.(1)�ٲ�������������װ��A�м��ȷֽ⣬���ɵ�����ͨ��װ��D������ͭ����ˮ�����Ĵ��ڣ�ͨ��װ��B�г���ʯ��ˮ���������̼�����ɣ�ͨ��װ��E�м�ʯ�Ҹ��������ͨ��װ��C�в������У�������ͭ��Ӧ����ͭ�Ͷ�����̼����ͨ��Bװ�ü������ɵĶ�����̼���壬�������������ҵķ�������װ����ȷ���ӵ�˳��Ϊ��b��c��h��i(��i��h)��d��e((��e��d)��b��c���ʴ�Ϊ��b��c��h��i(��i��h)��d��e((��e��d)��b��c��
��ʵ��ǰ��ͨ��һ��ʱ��N2����Ŀ��Ϊ���ž�װ���еĿ�������ֹ����ʱ������ը���ʴ�Ϊ���ž�װ���еĿ�������ֹ����ʵ�飨����ը���������ļ��飩��
��ʵ��֤������������к���CO�����ݵ�ʵ������Ϊ��c�й����ɺ�ɫ��Ϊ��ɫ����Bװ���г��ֻ��ǣ��ʴ�Ϊ��c�й����ɺ�ɫ��Ϊ��ɫ����Bװ���г��ֻ��ǣ�
��Ϊ�˷�ֹ������������ȫ�¹ʣ�����ʵ��ʱ��Ϩ��A��C���ľƾ�����ֹͣͨ��N2���ʴ�Ϊ����ֹ������
(2)A����Ӧ���з�����Ӧ�Dz�����������ֽ���������������һ����̼��������̼��ˮ����Ӧ�Ļ�ѧ����ʽΪ��FeC2O4��2H2O![]() FeO+CO��+CO2��+2H2O���ʴ�Ϊ��FeC2O4��2H2O
FeO+CO��+CO2��+2H2O���ʴ�Ϊ��FeC2O4��2H2O![]() FeO+CO��+CO2��+2H2O��
FeO+CO��+CO2��+2H2O��
(3)FeC2O4�뷴ӦK3[Fe(CN)6]������ɫ��Fe3[Fe(CN)6]2����,ͬʱ����K2 C2O4���÷�Ӧ�Ļ�ѧ����ʽΪ��3FeC2O4+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2+3K2C2O4���ʴ�Ϊ��3FeC
��.(4) �ڲ���2��������KMnO4�ζ�����Fe2+��H2C2O4����Һ��KMnO4����ԭΪ��ɫ��Mn2+�����Եζ��յ������Ϊ��ƿ����Һ��ɫ��Ϊdz��ɫ����30s�ڲ���ɫ���ڲ���3�м���п�۵�Ŀ��Ϊ����Һ�е�Fe3+����ΪFe2+���Ա���ȷ����ҺH2C2O4�����ʵ�����������CԪ���غ㣬�����FeC2O4�����ʵ������ʴ�Ϊ���������һ����Һ��ɫ�仯Ϊ�Ϻ�ɫ�Ұ���Ӳ��䣬˵����Ӧ���е��յ㣻��Fe3+��ԭΪFe2+��
(5)������1������Һʱ����Fe2+�����������ĸ�����ؼ��٣�����õ������������ʵ�����С���ⶨ���ƫ�ͣ��ʴ�Ϊ��ƫ�͡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ������ʵ�����Ʊ���ˮ FeCl3 ���õ������� FeCl3 ��Һ�����������ϵ�֪����ˮ FeCl3 �ڿ������׳��⣬��������������ͼ������Ƶ�ʵ��װ��ͼ�����ȼ��г�װ����ȥ��
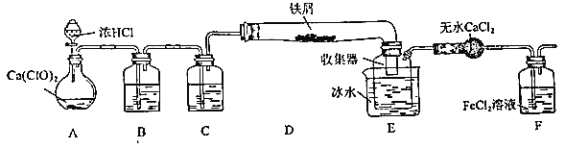
���������գ�
��1��װ�� A �� Cl2 ����װ�ã����еĻ�ѧ��Ӧ����ʽΪ_____
��2��B �е���Һ��_____��C ��������_____
��3��D ���Ⱥ��������� FeCl3 ������D ���Ҷˣ�Ҫʹ������ FeCl3 ����E��������______________
E �б�ˮ������Ϊ_____
��4��ʵ��Ա��ʦ������װ������� 2 ��Ľ����飺һ��װ�����Ӳ��ֶ��ijɱ������ӿڣ����������Ӽ���ԭ����_____����������װ�û�����һ���ܴ��ȱ�ݣ��Ľ��ķ�����_______________
��5��֤�� F�� FeCl2 δ����ȫ�����ķ�����_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.2 L��NaCl��Һ��MgCl2��Һ��CuCl2��Һ��ɵĻ����Һ�У��������ӵ�Ũ����ͼ��ʾ��
(1)���Һ�У�NaCl�����ʵ���Ϊ_______mol��MgCl2������Ϊ_______g��
(2)�û����Һ��CuCl2�����ʵ���Ũ��Ϊ_____molL��1�����û����Һ��ˮϡ�������Ϊ1 L��ϡ�ͺ���Һ��Cu2+�����ʵ���Ũ��Ϊ_______molL��1��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20mL0.1mol��L-1��HA��Һ����μ���0.1mol��L-1���ռ���Һ����Һ��ˮ�������cˮ��H+��������ռ���Һ����ı仯��ͼ��ʾ������˵����ȷ���ǣ� ��
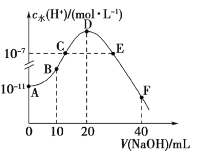
A.B�����Һ������Ũ��֮����ڣ�c(HA)��c(Na+)��c(A-)
B.��ͼ��֪A-��ˮ��ƽ�ⳣ��KhԼΪ1��10-9
C.C��E������Ϊ��ˮ�ĵ�����������úʹٽ�������ͬ��������Һ��������
D.F�����Һ�ʼ��ԣ�����Ũ��֮����ڣ�c(OH-)=c(HA)+c(A-)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������Ľ��ݣ�����A����A����A��Ԫ�������������ϵ���ҪԪ�ء���ش��������⣺
(1)��̬Geԭ�ӵĺ��������__�ֲ�ͬ�Ŀռ��˶�״̬��
(2)P��S��Cl�ĵ�һ�������ɴ�С��˳��Ϊ__��
(3)M��Gaλ��ͬ���ڣ�M3+��һ����������Ϊ[M(NH3)5(H2O)]Cl3��
�������й�NH3��H2O��˵����ȷ����__������ĸ����
a.���ӿռ乹����ͬ
b.����ԭ���ӻ�������ͬ
c.���Ǵ�С��ͬ
��1mol[M(NH3)5(H2O)]3+��__��������
�������T��[M(NH3)5(H2O)]Cl3���Ԫ�ص��������Ŀ��ͬ���������ӵ���λ����ͬ��1molT����ˮ����������AgNO3��Һ������2molAgCl����T�Ļ�ѧʽΪ___��
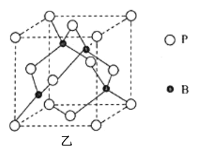
(4)��ͼ��Ϊ���ᾧ���Ƭ��ṹ����������ӻ���ʽΪ__��H3BO3����ˮ�б���ˮ���ܽ�������������Ҫԭ����__��
(5)����(BP)��һ�ֳ�Ӳ��ĥͿ����ϣ��侧���ṹ��ͼ����ʾ���þ�����Bԭ���������ɼ�����Ŀռ乹��Ϊ__������������������������������������������������֪�þ�����ܶ�Ϊ��g��cm-3��NA�ǰ����ӵ�������ֵ��BP������������6��Pԭ�����������������壬����������ı߳�Ϊ__pm����ʽ���ɣ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ѧ��Ӧ��:Fe(s)+CO2(g)![]() FeO(s)+CO(g),�仯ѧƽ�ⳣ��ΪK1;��ѧ��Ӧ��:Fe(s)+H2O(g)
FeO(s)+CO(g),�仯ѧƽ�ⳣ��ΪK1;��ѧ��Ӧ��:Fe(s)+H2O(g)![]() FeO(s)+H2(g),�仯ѧƽ�ⳣ��ΪK2,���¶�973 K��1173 K�������,K1��K2��ֵ�ֱ�����:
FeO(s)+H2(g),�仯ѧƽ�ⳣ��ΪK2,���¶�973 K��1173 K�������,K1��K2��ֵ�ֱ�����:
�¶� | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)ͨ�������е���ֵ�����ƶ�:��Ӧ����_______(��������������������)��Ӧ��
(2)���з�Ӧ��:CO2(g)+H2(g)![]() CO(g)+H2O(g),����д���÷�Ӧ��ƽ�ⳣ��K3�ı���ʽ:K3=______��
CO(g)+H2O(g),����д���÷�Ӧ��ƽ�ⳣ��K3�ı���ʽ:K3=______��
(3)���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵʽΪ__________,�ݴ˹�ϵʽ���ϱ�����,���ƶϳ���Ӧ����________(��������������������)��Ӧ��
(4)Ҫʹ��Ӧ����һ�������½�����ƽ��������Ӧ�����ƶ�,�ɲ�ȡ�Ĵ�ʩ��______ ��_____ (��д��ĸ���)��
A.��С��Ӧ�������ݻ� B.����Ӧ�������ݻ�
C.�����¶� D.ʹ�ú��ʵĴ���
E.�跨��Сƽ����ϵ�е�CO��Ũ��
(5)ͼ�ס��ҷֱ��ʾ��Ӧ����t1ʱ�̴ﵽƽ��,��t2ʱ����ı�ij�������������仯�����:
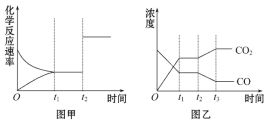
��ͼ����t2ʱ�̷����ı��������__________��
��ͼ����t2ʱ�̷����ı��������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��������ȷ����
A.��Ͷ��ˮ�е����ӷ���ʽ�� Na��2H2O��Na+��2OH����H2��
B.һˮ�ϰ��ĵ��뷽��ʽ�� NH3H2O![]() NH4����OH��
NH4����OH��
C.����ͭ��Һ������������Һ��Ӧ�����ӷ���ʽ��Ӧ��Ba2+��SO42��BaSO4��
D.��������ˮ�����ӷ���ʽ��Cl2��H2O![]() 2H����Cl����ClO��
2H����Cl����ClO��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��ͬѧ��̽��NH3�Ĵ�������Ӧ������ͼװ�ý���ʵ�顣A��Bװ�ÿ�ѡ�õ�ҩƷ��Ũ��ˮ��H2O2��Һ������ˮ��NaOH���塢MnO2��

(1)NH3�������Ļ�ѧ����ʽ��____��
(2)�ס�����ͬѧ�ֱ���ͼװ�ý���ʵ�顣һ��ʱ���װ��G�е���Һ�������ɫ��
�ټ۲쵽װ��F���к���ɫ���壬���ɺ���ɫ����Ļ�ѧ����ʽ��___��
���ҹ۲쵽װ��F��ֻ�а������ɣ����̵ijɷ���___(�ѧʽ)��
�������ӷ���ʽ����װ��G����Һ�����ɫ��ԭ��___��
(3)Ϊ������ʵ����װ��F��Ҳ�۲쵽����ɫ���壬��θĽ�___��
(4)Ϊʵ�ָ÷�Ӧ��Ҳ������ͼ��ʾ��װ���滻ԭװ�������߿֡�
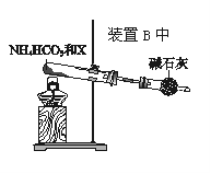
������XΪ__��NH4HCO3��������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦA2(g) + B2(g)��2AB(g) �������仯��ͼ��ʾ��������������ȷ����( )
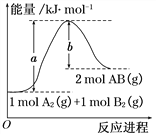
A.ÿ����2mol AB(g) ������b kJ����
B.�÷�Ӧ����H = +(a-b) kJ��mol-1
C.��Ӧ��������������������������
D.����1 mol A��A�����ų�a kJ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com