
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
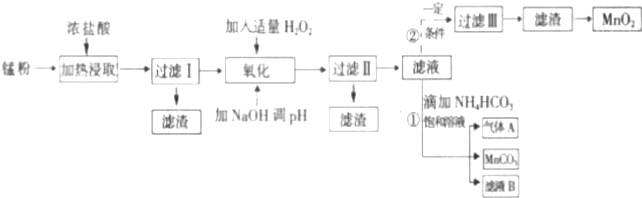
分析 锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]在浓盐酸中加热、浸取,发生MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O、2MnO(OH)+6HCl=2MnCl2+Cl2↑+3H2O、Fe+2HCl=FeCl2+H2↑等反应,过滤后所得滤渣为碳黑,滤液中含有Mn2+、Fe2+、NH4+、Zn2+等离子,在滤液中加入适量过氧化氢和氢氧化钠,可将Fe2+转化为Fe3+,并生成Fe(OH)3,控制溶液pH在8.5<pH<8.8之间可除去Fe3+、Zn2+,过滤后所得滤液Ⅱ主要为Mn2+,滤液Ⅱ中H2O2溶液,在一定条件下使Mn2+转化成MnO2,经过滤、洗涤、干燥可得MnO2,滤液Ⅱ中加入碳酸氢铵饱和溶液,发生反应Mn2++2HCO3-=MnCO3+CO2↑+H2O,得到碳酸锰沉淀、氯化铵溶液和气体A为CO2,以此解答该题.
解答 解:锰粉[含MnO2、MnO(OH)、Zn(NH3)2Cl2、Fe、NH4Cl和炭黑等]在浓盐酸中加热、浸取,发生MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O、2MnO(OH)+6HCl=2MnCl2+Cl2↑+3H2O、Fe+2HCl=FeCl2+H2↑等反应,过滤后所得滤渣为碳黑,滤液中含有Mn2+、Fe2+、NH4+、Zn2+等离子,在滤液中加入适量过氧化氢和氢氧化钠,可将Fe2+转化为Fe3+,并生成Fe(OH)3,控制溶液pH在8.5<pH<8.8之间可以除去Fe3+、Zn2+,过滤后所得滤液Ⅱ主要为Mn2+,滤液Ⅱ中H2O2溶液,在一定条件下使Mn2+转化成MnO2,经过滤、洗涤、干燥可得MnO2,滤液Ⅱ中加入碳酸氢铵饱和溶液,发生反应Mn2++2HCO3-=MnCO3+CO2↑+H2O,得到碳酸锰沉淀、氯化铵溶液和气体A为CO2,
(1)根据上面的分析可知,过滤Ⅰ得到的滤渣主要成分是碳黑,
故答案为:碳黑;
(2)流程中氧化后加入NaOH溶液调节pH的范围为8.5<pH<8.8,其作用是除去Fe3+、Zn2+,
故答案为:除去Fe3+、Zn2+;
(3)过滤Ⅱ后滤液中阳离子主要是Mn2+,
故答案为:Mn2+;
(4)根据上面的分析可知,气体A是 CO2,
故答案为:CO2;
(5)请写出酸性锌锰干电池生成锰粉中给出产物的总反应式 Zn+2MnO2+2NH4Cl=2MnOOH+Zn(NH3)2Cl2,
故答案为:Zn+2MnO2+2NH4Cl=2MnOOH+Zn(NH3)2Cl2;
(6)MnO2与H2C2O4 发生氧化还原反应生成锰离子与二氧化碳,反应的离子方程式为MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O,根据电子得失守恒可知关系式:2KMnO4~5H2C2O4,由题意可知,与H2C2O4反应的KMnO4的物质的量为0.1mol/L×0.03L=0.003mol,则被KMnO4氧化的H2C2O4的物质的量为0.0075mol,H2C2O4 的总物质的量为0.50mol/L×0.05L=0.025mol,所以与二氧化锰反应的H2C2O4 的物质的量为0.025mol-0.0075mol=0.0175mol,则样品中二氧化锰的物质的量为0.0175mol,锰粉中的锰元素质量分数是$\frac{0.0175mol×55g/mol}{4g}$×100%=24.06%,
故答案为:MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O;24.06%.
点评 本题通过MnO2及MnCO3的制备,考查了物质制备实验方案的设计方法,题目难度较大,明确制备流程及相应的反应原理为解答关键,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| 序号 | 实验事实 | 结论 |
| A | SO3的水溶液可以导电 | SO3是电解质 |
| B | 向某溶液中加入BaCl2溶液和稀HNO3,若有白色沉淀生成 | 原溶液中含SO42- |
| C | Ca(ClO)2溶液中通入CO2产生白色沉淀 | 酸性:H2CO3>HClO |
| D | 用铂丝蘸取某溶液在酒精灯火焰上灼烧直接观察火焰颜色,未见紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑤ | C. | ③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量就是指物质的数量 | |
| B. | 硫酸的摩尔质量为98g | |
| C. | 标准状况下,0.5mol CCl4的体积为11.2L | |
| D. | 20.00 mL 0.5 mol/L的Ca(NO3)2溶液中NO3-的物质的量为0.02 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com