
| A. | CH3CH(CH3)2 属于链状化合物 | B. | 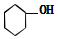 属于酚类化合物 | ||
| C. | 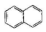 属于苯的同系物 | D. | 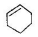 属于芳香族化合物 |
分析 A.CH3CH(CH3)2是异丁烷,属于链状化合物;
B.该有机物分子中不含苯环,不属于酚类;
C.苯的同系物中只能含有1个苯环,该有机物中含有2个苯环;
D.该有机物分子中不存在苯环.
解答 解:A.CH3CH(CH3)2是异丁烷,属于链状化合物,故A正确;
B. 分子中不含苯环,属于醇类,故B错误;
分子中不含苯环,属于醇类,故B错误;
C. 分子中含有两个苯环,不属于苯的同系物,故C错误;
分子中含有两个苯环,不属于苯的同系物,故C错误;
D.芳香族化合物指含有苯环的化合物,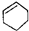 不含苯环,属于环烯,故D错误;
不含苯环,属于环烯,故D错误;
故选A.
点评 本题考查了烃的衍生物的官能团及结构,题目难度不大,明确常见有机物组成、结构及分类方法为解答关键,注意掌握常见官能团的类型,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 200 mL | B. | 300 mL | C. | 600 mL | D. | 700 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导电性强的溶液一定是强电解质溶液 | |
| B. | H2SO4是强电解质,稀硫酸中没有H2SO4分子 | |
| C. | NaCl晶体是由Na+和Cl-组成,NaCl晶体是良导体 | |
| D. | 氯气和氨气的水溶液导电性都很好,所以它们是强电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在燃煤时加入适量石灰石,可减少 SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2 | |
| B. | 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶液的 PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4 | |
| C. | 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2═I2 +2H2O | |
| D. | 在盐碱地(含较多 NaCl、Na2CO3)上通过施加适量 CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验① | 实验② | 实验③ |
| 将铁钉放入硫酸 铜溶液中 | 向硫酸亚铁溶液中 滴入几滴浓硝酸 | 将铜丝放入 氯化铁溶液中 |
| A. | 可以用实验①的方法冶炼铜 | |
| B. | 实验②中Fe2+既显氧化性又显还原性 | |
| C. | 实验③中发生置换反应 | |
| D. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 操作 | 现象 |
| A | BaSO3难溶于水 | 将SO2通入Ba(NO3)2溶液中 | 有白色沉淀生成 |
| B | 验证非金属性:Br>I | 将溴水滴加到淀粉KI溶液中 | 溶液变蓝 |
| C | 验证SO2的漂白性 | 将SO2通入酸性KMnO4溶液中 | KMnO4溶液褪色 |
| D | 验证某化合物一定是钠盐 | 该化合物在酒精灯上灼烧 | 焰色为黄色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
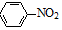 +4Mg+8CH3OH→
+4Mg+8CH3OH→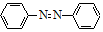 +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com